
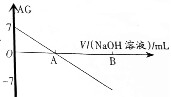
 若用AG表示溶液的酸度(acidity grade),AG的定义为AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$].室温下实验室中用0.01mol•L-1的氢氧化钠溶液滴定20.00mL0.01mol•L-1的醋酸,滴定过程如图所示,下列叙述正确的是( )
若用AG表示溶液的酸度(acidity grade),AG的定义为AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$].室温下实验室中用0.01mol•L-1的氢氧化钠溶液滴定20.00mL0.01mol•L-1的醋酸,滴定过程如图所示,下列叙述正确的是( )| A. | 室温下,醋酸的电离常数约为10-6 | |
| B. | A点时加入氢氧化钠溶液的体积为20.00mL | |
| C. | 若B点为40mL,所得溶液中:c(OH-)=c(CH3COO-)+c(H+)+2c(CH3COOH) | |
| D. | 反应过程中一定存在:0.01mol•L-1+c(OH-)=c(Na+)+c(H+)+c(CH3COOH) |
分析 A、室温下,醋酸的AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$]=7,结合水的离子积K=c(H+)•c(OH-)来计算;
B、A点的AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$]=0;
C、根据当B点加入NaOH溶液为40mL时,所得的为等浓度的CH3COONa和NaOH的混合溶液,然后根据电荷守恒和物料守恒来分析;
D、反应过程中根据电荷守恒一定存在:c(OH-)+c(CH3COO-)=c(Na+)+c(H+).
解答 解:A、室温下,醋酸的AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$]=7,即$\frac{c({H}^{+})}{c(O{H}^{-})}$=107,而水的离子积K=c(H+)•c(OH-)=10-14,两式联立可知:c(H+)=10-3.5,而在醋酸溶液中,c(CH3COO-)≈c(H+)=10-3.5,故电离平衡常数K=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{1{0}^{-3.5}×1{0}^{-3.5}}{0.01}$=10-5,故A错误;
B、A点的AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$]=0,即$\frac{c({H}^{+})}{c(O{H}^{-})}$=1,即c(H+)=c(OH-),溶液显中性,而当加入氢氧化钠溶液20mL时,恰好和醋酸完全中和,得到醋酸钠溶液,溶液显碱性,故B错误;
C、当B点加入NaOH溶液为40mL时,所得的为等浓度的CH3COONa和NaOH的混合溶液,根据电荷守恒和物料守恒可知:c(OH-)+c(CH3COO-)=c(Na+)+c(H+),c(Na+)=2[c(CH3COO-)+c(CH3COOH)],两式联立可得:c(OH-)=c(CH3COO-)+c(H+)+2c(CH3COOH),故C正确;
D、反应过程中根据电荷守恒一定存在:c(OH-)+c(CH3COO-)=c(Na+)+c(H+),但由于两溶液混合后溶液体积发生改变,故c(CH3COOH)+c(CH3COO-)≠0.01mol/L,故0.01mol•L-1+c(OH-)=c(Na+)+c(H+)+c(CH3COOH)不成立,故D错误.
故选C.
点评 本题考查了酸碱中和滴定的过程中平衡常数的计算以及三个守恒的运用,难度不大,注意离子浓度随着溶液体积的改变而发生的变化.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Na→NaOH→Na2CO3→NaCl | B. | Cu→CuO→Cu (OH)2→CuCl2 | ||
| C. | Mg→MgCl2→Mg(OH)2→MgSO4 | D. | Fe→FeCl2→Fe(OH)2→Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在氯气中点燃细铁丝产生白色的烟 | |
| B. | 铁粉和硫粉混合加热生成黑色固体 | |
| C. | 纯铝在空气中放置会长出白毛 | |
| D. | 将铝片放入CuSO4溶液反应完全后,溶液由蓝色变为红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{54}$ | B. | $\frac{1}{6.75}$ | C. | $\frac{1}{27}$ | D. | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以确定该微粒为Ne | |
| B. | 对应元素可能位于元素周期表中第13列 | |
| C. | 它的单质可能是强还原剂 | |
| D. | 对应元素可能是电负性最大的元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com