
【题目】目前流通的第五套人民币硬币材料分别为:1元硬币为铜芯镀镍合金,5角硬币为铜芯镀铜合金,1角硬币为硬铝合金.请回答:(题目中的百分含量均为质量分数)

(1)钢是含碳量为0.03%~2%的________(填物质类别名称).
(2)如图所示的装置中,甲、乙、丙三个烧杯分别盛放足量的溶液,电极及溶液如下表所示:
电极 | a | b | c | d | e | f |
石墨 | 石墨 | 铜 | 钢 | 钢 | 铜 | |
溶液 | NaCl溶液 | CuSO4溶液 | CuSO4溶液 | |||
通电后电极a上可产生能使湿润的碘化钾淀粉试纸变蓝的气体.
①上述装置中M极为直流电源的________极(填“正”或“负”),电极b上发生的电极反应式为________.
②若在钢币上镀铜,应选择_________烧杯(填“乙”或“丙”),当电极a上生成标准状况下气体2240mL时,理论上可在电极________(填字母)上镀铜________g.
(3)工业上以铝土矿(主要成分Al2O3nH2O,含少量的氧化铁和石英等杂质)为原料生产铝.为除去铝土矿样品中氧化铁和石英杂质,要将粉碎、筛选后的铝土矿样品溶解在足量的氢氧化钠溶液中处理,请写出有关反应的离子方程式 ________.
(4)已知硬铝中含Cu:2.2%~5%、Mg:0.2%~3%、Mn:0.3%~1.5%、Si:0.5%,其余是Al.1角硬币单枚质量为2.20克,若想制得1角硬币1百万枚,理论上至少需要含Al2O3 90%的铝土矿约________吨(小数点后保留一位数字).
【答案】 (铁)合金 正 2H2O+2e﹣=H2↑+2OH﹣(或2H++2e﹣=H2↑) 乙 d 6.4 Al2O3+2OH﹣=2AlO2﹣+H2O SiO2+2OH﹣=SiO32﹣+H2O 4.2
【解析】
(1)钢是含碳量为0.03%~2%的(铁)合金,故答案为:(铁)合金;
(2)①能使湿润的碘化钾淀粉试纸变蓝的气体是氯气,在阳极上氯离子失电子发生氧化反应,即2Cl--2e-=Cl2↑,故M为正极,b为阴极,氢离子放电,电极反应式为:2H++2e-=H2↑,故答案为:正;2H2O+2e-=H2↑+2OH-(或2H++2e-=H2↑);
②镀铜时,应用含铜离子的溶液做电解质溶液;电极a上电极反应式:2Cl--2e-=Cl2↑,当生成氯气的体积2240mL时,转移0.2mol电子,d极是阴极上是铜离子放电,即Cu2++2e-→Cu,当转移则0.2mol电子时,生成的铜为0.1mol,其质量为6.4g,故答案为:乙;d;6.4;
(3)氧化铁不与氢氧化钠反应,Al2O3和氢氧化钠反应生成偏铝酸钠,二氧化硅和氢氧化钠反应生成硅酸钠,故答案为:Al2O3+2OH-=2AlO2-+H2O,SiO2+2OH-=SiO32-+H2O;
(4)硬铝中含铝最多为:1-2.2%-0.2%-0.3%-0.5%=96.8%,1角硬币单枚质量为2.20克,1百万枚质量为2.20×1000000g=2.2吨,设需要含氧化铝90%的铝土矿的质量为x.
2Al2O3![]() 4Al+3O2↑
4Al+3O2↑
204 108
90%x ![]()
![]() =
=![]() ,解得x=4.2t,故答案为:4.2。
,解得x=4.2t,故答案为:4.2。


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】用惰性电极电解下列电解质溶液,有关叙述正确的是( )
A. 等物质的量浓度的NaCl和AlCl3混合液完全电解后,所得的混合液的pH值增大
B. NaCl溶液电解一定时间后,要恢复到电解前状态,应加入适量盐酸
C. Na2SO4溶液在电解过程中,阴极区pH值降低
D. 电解CuSO4溶液,阳极反应式为:2H2O+O2+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁可用作燃料的节能消烟剂、抗爆剂等。实验室制备二茂铁装置示意图如右下图(二茂铁熔点是173℃,在100℃时开始升华;沸点是249℃)。实验步骤为:
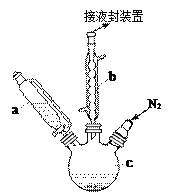

①在三颈烧瓶中加入25g粉末状的KOH,并从仪器a中加入60mL无水乙醚到烧瓶中,充分搅拌,同时通氮气约10min;
②再从仪器a滴入5.5mL新蒸馏的环戊二烯(密度0.95g/cm3),搅拌;
③将6.5g无水FeCl2与(CH3)2SO(二甲亚砜,作溶剂)配成的溶液25ml装入仪器a中,慢慢滴入仪器c中,45min滴完,继续搅拌45min;
④再从仪器a加入25mL无水乙醚搅拌;
⑤将c中的液体转入仪器d,依次用盐酸、水各洗涤两次,分液得橙黄色溶液;
⑥蒸发橙黄色溶液,得二茂铁粗产品。
回答下列问题:
(1)仪器b的名称是_________,作用是_________________________。
(2)步骤①中通入氮气的目的是________________________________。
(3)仪器c的适宜容积应为______:①100ml、②250ml、③500ml;仪器a使用前应进行的操作是_____,其操作过程为:关闭恒压滴液漏斗颈部旋塞_______________________。
(4)KOH、FeCl2、C5H6反应生成二茂铁[Fe(C5H5)2]和KCl的化学方程式为________________________________;步骤⑦是二茂铁粗产品的提纯,该过程在右图中进行,其操作名称为__________。
(5)为了确证得到的是二茂铁,还需要进行的一项简单实验是_____。
(6)最终得到纯净的二茂铁3.7g,则该实验的产率为_______(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由 Al、CuO、Fe2O3 组成的混合物共 10.0g,放入 500mL 某浓度盐酸溶液中,混合物完全溶解,当再 加入 250mL 2.0mol/L 的 NaOH 溶液时,得到的沉淀最多。该盐酸的浓度为( )
A. 0.5 mol/L B. 3.0 mol/L C. 1.0 mol/L D. 2.0 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在我国使用最早的合金是________,目前用量最大,用途最广泛的合金是________.
(2)0.5mol H2O 的质量为________g,共有________个原子.
(3)质量都是50g 的Cl2、NH3、CO2、O2 四种气体中,含有分子数最少的是________;在相同的温度和压强下,体积最大的是________.
(4)配制100mL 0.2mol/L CuSO4溶液,需要CuSO45H2O________g.
(5)在配制硫酸亚铁溶液时,常常加入铁粉,请说明原因________(用离子方程式表示)
(6)过氧化钠跟水反应的化学方程式是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下图两种化合物的结构或性质描述正确的是( )
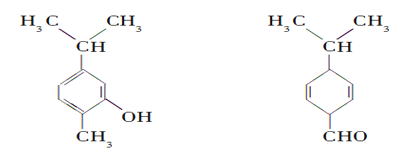
A. 不是同分异构体
B. 分子中共平面的碳原子数相同
C. 均能与溴水反应
D. 可用红外光谱区分,但不能用核磁共振氢谱区分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,3-丁二烯和马来酸酐(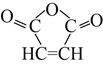 )是重要的化工原料,可用于合成可降解的PBS塑料和衣康酸。
)是重要的化工原料,可用于合成可降解的PBS塑料和衣康酸。

已知:
(1)反应①的反应类型是_______________________。
(2)C的分子式是C4H4O4,是一种二元羧酸。C为顺式结构,结构简式是____________。
(3)反应②的化学方程式是__________________________________________________。
(4)E的分子式C6H8O4。
i.G的名称是________________。
ii.H的结构简式是____________________________。
(5)与衣康酸具有相同种类和数目的官能团的同分异构体的数目是_________(不考虑顺反异构)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com