
| A. | 2KOH(aq)+H2SO4(aq)═K2SO4(aq)+2H2O(1)△H=-114.6 kJ•mol-1此时中和热△H=-114.6 kJ•mol-1 | |
| B. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(1)△H=+57.3 kJ•mol-1 | |
| C. | H2SO4和NaOH反应的中和热△H=-57.3 kJ•mol-1 | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ 热量 |
分析 A.在稀溶液中,稀的酸跟碱发生中和反应而生成1mo水,这时的反应热叫做中和热;
B.酸碱中和反应为放热反应;
C.在稀溶液中,稀的酸跟碱发生中和反应而生成1mo水,这时的反应热叫做中和热;
D.弱酸电离时吸热.
解答 解:A.在稀溶液中,稀的酸跟碱发生中和反应而生成1mo水,这时的反应热叫做中和热,中和热为△H=-57.3 kJ•mol-1,则KOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$K2SO4(aq)+H2O(l)△H=-57.3 kJ•mol-1,故A错误;
B.酸碱中和反应为放热反应,则NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=-57.3 kJ•mol-1,故B错误;
C.H2SO4和NaOH反应硫酸钠和水,所以中和热△H=-57.3 kJ•mol-1,故C正确;
D.弱酸电离时吸热,则稀醋酸与稀NaOH溶液反应生成1 mol水,放出的热量小于57.3 kJ,故D错误.
故选C.
点评 本题主要考查学生对中和热的概念的理解和掌握以及热化学方程式的书写问题,题目难度不大,注意弱酸的电离过程要吸热.


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:解答题
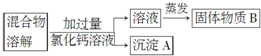
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属腐蚀就是金属失去电子被还原的过程 | |
| B. | 铜板上的铁铆钉处在潮湿的空气中直接发生反应:Fe-3e+=Fe3+,继而形成铁锈 | |
| C. | 将水库中的水闸(钢板)与外加直流电源的负极相连接,正极连接到一个废铁上可防止水闸被腐蚀 | |
| D. | 合金的熔点都高于它的成分金属,合金的耐腐蚀性也都比其成分金属强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是放热反应都是自发的,吸热反应都是非自发的 | |
| B. | 化学反应的方向与反应的熵变无关 | |
| C. | 室温下,CaCO3(s)=CaO(s)+CO2(g)不能自发进行,说明该反应△H<0 | |
| D. | 同一物质:固体→液体→气体的变化是焓增和熵增的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 萃取操作时,可以选用CCl4或酒精作为萃取剂从溴水中萃取溴 | |
| B. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| C. | 分液操作时,先将分液漏斗中下层液体从下口放出,再将上层液体从下口放出 | |
| D. | 蒸馏操作时,应向蒸馏液体中加入几块沸石,以防止暴沸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体系压强保持不变 | |
| B. | 混合气体颜色保持不变 | |
| C. | SO3的体积百分数保持不变 | |
| D. | 每消耗1 mol SO3的同时生成1 mol NO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是Zn和Cu形成的原电池,下列描述合理的是( )
如图是Zn和Cu形成的原电池,下列描述合理的是( )| A. | ①②③ | B. | ②④ | C. | ④⑤⑥ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3在反应中得到电子 | B. | O2在反应中失去电子 | ||
| C. | NO是反应的还原产物 | D. | 1mol氧化剂在反应中得到4mol电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com