
在体积为2L的密闭容器中充有2mol SO2和一定量的O2,发生反应2SO2+O2 2SO3.当反应进行到4min时,测得此时SO2为0.4mol,那么反应进行到2min时,密闭容器中SO2物质的量是( )
2SO3.当反应进行到4min时,测得此时SO2为0.4mol,那么反应进行到2min时,密闭容器中SO2物质的量是( )
A.小于1.2 mol B.1.2 mol C.大于1.6 mol D.1.6 mol
科目:高中化学 来源: 题型:多选题
| A | B | C | D |
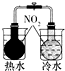 |  |  |  |
| 证明温度对平衡移动的影响验证 | 实现了化学能与电能相互转化 | 验证铁钉发生吸氧腐蚀 | 制备少量的氧气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁沈阳东北育才学校高二阶段考一化学卷(解析版) 题型:选择题
如图I所示,甲、乙之间的隔板K和活塞F都可以左右移动,F受压力恒定.甲中充入2mol A和1mol B,乙中充入2mol C和1mol He,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g) 2C(g),反应达到平衡后,再恢复至原温度,则下列说法正确的是( )
2C(g),反应达到平衡后,再恢复至原温度,则下列说法正确的是( )

A.达到平衡时,隔板K最终停留在0刻度左侧的2到4之间
B.若达到平衡时,隔板K最终停留在左侧1处,则乙中C的转化率小于50%
C.若达到平衡时,隔板K最终停留在左侧靠近2处,则乙中F最终停留在右侧的刻度大于4
D.如图II所示若x轴表示时间,则y轴可表示甲乙两容器中气体的总物质的量或A的物质的量
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁沈阳东北育才学校高二阶段考一化学卷(解析版) 题型:选择题
为探讨反应X+Y Z中反应速率与反应物浓度的关系,实验测得X、Y的初始浓度(用c表示,mol/L)与生成物Z的浓度达到0.0042mol/L时所需的时间如右表所示.下列关于该反应反
Z中反应速率与反应物浓度的关系,实验测得X、Y的初始浓度(用c表示,mol/L)与生成物Z的浓度达到0.0042mol/L时所需的时间如右表所示.下列关于该反应反 应速率的判断正确的是( )
应速率的判断正确的是( )
c(X) | c(Y) | 所需时间(秒) |
0.10 | 0.10 | 0.60s |
0.20 | 0.10 | 0.15s |
0.20 | 0.05 | 0.30s |
A.与c(X)成正比且与c(Y)成正比
B.与c(X)成正比且与c(Y)无关
C.与c2(X)成正比且与c(Y)成正比
D.与c2(X)成正比且与c(Y)成反比
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 1.0 | 1.6 | 2.0 | 2.0 |
 产生的氢气经干燥装置并用针筒收集;V(H2)随时间t变化如右图所示.下列叙述正确的是BC(双选题).
产生的氢气经干燥装置并用针筒收集;V(H2)随时间t变化如右图所示.下列叙述正确的是BC(双选题).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 3:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com