
| m |
| M |
| n |
| V |
| 1.43g |
| 286g/mol |
| 0.01mol |
| 0.1L |


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
| A、等物质的量的N2和CO所含分子数均为NA |
| B、1 mol Na2O2 固体中含离子总数为4 NA |
| C、1.7 g H2O2中含有的电子数为0.9 NA |
| D、标准状况下,2.24 L甲烷所含共价键数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1173 kJ |
| B、1456 kJ |
| C、2022 kJ |
| D、2346 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:

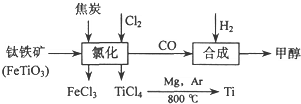
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3O4可写成FeO?Fe2O3,Pb3O4也可写成PbO?Pb2O3 |
| B、NaCl与HCl化学式相似,故NaCl与HCl的结构也相似 |
| C、由“2Fe+3Cl2═2FeCl3”反应可推出“2Fe+3I2═2FeI3”反应也能发生 |
| D、金属镁失火不能用CO2灭火;金属钠失火也不能用CO2灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 常温下,用 0.1000mol/L NaOH 溶液分别滴定 20.00mL 0.1000mol/L HA 溶液(滴定曲线见图1)和20.00mL 0.1000mol/L HB溶液(滴定曲线见图2).下列说法正确的是( )
常温下,用 0.1000mol/L NaOH 溶液分别滴定 20.00mL 0.1000mol/L HA 溶液(滴定曲线见图1)和20.00mL 0.1000mol/L HB溶液(滴定曲线见图2).下列说法正确的是( )| A、图1可以表示NaOH滴定醋酸的曲线 |
| B、图1中B点状态时,溶液中有:c(Na+)=c(A-) |
| C、达到B、E状态时,反应消耗的n(HA)<n(HB) |
| D、当0mL<V(NaOH)<20.00mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(A-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解时,石墨作阴极,铁作阳极 |
| B、电解时,在阴极上产生KIO3 |
| C、电解后电解质溶液pH变大 |
| D、电解中每转移0.6mol e-,理论上可得到0.1mol无水KIO3晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com