
【题目】元素R、T、X、Y、Z在元素周期表中的相对位置如下图所示,其中Z单质与H2混合遇强光会发生爆炸。则下列判断错误的是
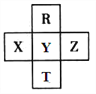
A. 原子半径 Z>Y>R
B. R与Y的电子数相差8
C. 非金属性:Z>Y>X
D. HZO4是目前无机酸中最强的含氧酸
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
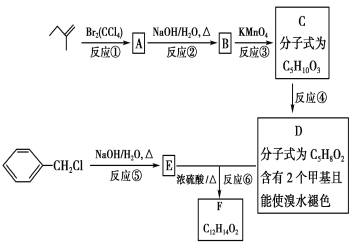
【题目】有机物F可用于制造香精,可利用下列路线合成。
回答下列问题:
(1)![]() 分子中可能共面的原子最多有________个;
分子中可能共面的原子最多有________个;
(2)物质A的名称是__________________________________;
(3)物质D中含氧官能团的名称是_____________________________;
(4)“反应④”的反应类型是_____________________________________;
(5)写出“反应⑥”的化学方程式:______________________________________________;
(6)C有多种同分异构体,与C中所含有的官能团相同的有__________种,其中核磁共振氢谱为四组峰的结构简式为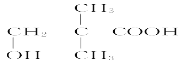 和______________________________。
和______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象能推出相应结论的是
选项 | 实验操作和现象 | 结论 |
A | 向NaAlO2溶液中滴加NaHCO3 溶液,产生白色沉淀 | AlO2-与HCO3-发生了相互促进的水解反应 |
B | 向溶有SO2的BaCl2溶液中通入气体X,出现白色沉淀 | X不一定具有氧化性 |
C | 灼热的木炭加入浓硝酸中,放出红棕色气体 | 一定是木炭与浓硝酸反应生成了NO2 |
D | 将乙醇与浓硫酸共热,制得的气体直接通入酸性KMnO4溶液中,酸性KMnO4溶液褪色 | 说明制得的气体中含有乙烯 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验事实不能用平衡移动原理解释的是
A. pH=11的氨水稀释10倍后溶液pH>10
B. 将氯化铝溶液加热蒸干并灼烧,最终得氧化铝固体
C. 对2HI(g)![]() H2(g)+I2(g),减小容器体积,气体颜色变深
H2(g)+I2(g),减小容器体积,气体颜色变深
D. 水垢中含有CaSO4,可先用Na2CO3溶液浸泡处理,而后用盐酸去除
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F(C11H12O2)属于芳香酯类物质,可由下列路线合成:
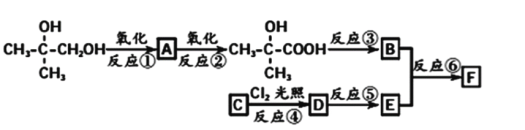
已知:B在一定条件下可发生加聚反应形成高分子化合物
回答下列问题:
(1)A中官能团的名称是____________,上述③④⑤⑥反应中属于取代反应的有_____(填相应序号)
(2)反应③的条件是___________________。
(3)写出B发生加聚反应形成高分子化合物的化学方程式____________________。
(4)反应⑥的化学方程式是__________________________________
(5)A、B、E三种有机物,可用下列的某一种试剂鉴别,该试剂是______.
a.新制的Cu(OH)2悬浊液 b.溴水 c.酸性KMnO4溶液 d.溴的CCl4溶液
(6)G是E的同系物且相对分子质量比E大28.G有多种同分异构体,其中符合下列条件的同分异构体有_____种①能与Na2CO3溶液反应 ②分子中含有两个-CH3.其中核磁共振氢谱有5组峰,且面积比为6:1:2:2:1的结构简式____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列哪一事实能说明生物界与非生物界具有统一性
A. 生物与非生物都具有化学变化
B. 生物与非生物都由元素构成
C. 组成生物体的化学元素在无机自然界中都可以找到
D. 生物与非生物都含有碳元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,又是一种重要的化工原料.具有广阔的开发和应用前景。工业上可用如下方法合成甲醇:CO(g)+2H2(g)![]() CH3OH(g).
CH3OH(g).
(1) 已知:①2CH3OH(l)+3O2(g)![]() 2CO2(g)+4H2O(g)△H=-1275.6kJ·mol-1;
2CO2(g)+4H2O(g)△H=-1275.6kJ·mol-1;
②2CO(g)+O2(g)![]() 2CO2(g)△H=-566.0kJ·mol-1;
2CO2(g)△H=-566.0kJ·mol-1;
③H2O(l)=H2O(g)△H=+44.0kJ·mol-1.
则甲醇液体不完全燃烧生成CO和液态水的热化学方程式为__________。
(2) 在一定温度下,向2L密闭容器中充人1mol CO和2mol H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),5min反应达到平衡,此时CO的转化率为80%。
CH3OH(g),5min反应达到平衡,此时CO的转化率为80%。
①前5min内甲醇的平均反应速率为__________;已知该反应在低温下能自发进行,则反应的△H_______0(填“>”“<”或“=”)。
②在该温度下反应的平衡常数K=__________。
③某时刻向该平衡体系中加人CO、H2、CH3OH各0.2mol后,则v正__________v逆(填“>”“=”或“<”)。
④当反应达到平衡时,__________(填字母)。
a.混合气体的压强不再发生变化 b.反应物不再转化为生成物
c.v正(CO)=2v逆(H2) d.v(H2)=2v(CH3OH)
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
(3) "甲醇---过氧化氢燃料电池"的结构主要包括燃料腔、 氧化剂腔和质子交换膜三部分.放电过程中其中一个腔中生成了CO2。
①放电过程中生成H+的反应,发生在__________腔中,该腔中的电极反应式为__________.
②该电池工作过程中,当消耗甲醇4.8g时.电路中通过的电量为__________(法拉第常数F=9.65×104C·mol-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在细胞内含量极少,但对维持生命活动必不可少的元素有
A. Fe Mn Zn Mg B. Zn Cu Mg Ca
C. Zn Cu B Mn D. Mg Mn Cu Mo
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按系统命名法填写下列有机物的名称及有关内容。
(1).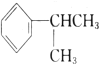 的名称是________.
的名称是________.
(2).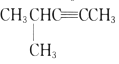 的分子式为__,1mol该烃完全燃烧消耗O2__mol.
的分子式为__,1mol该烃完全燃烧消耗O2__mol.
(3).分子式为C4H8的所有烯烃的结构简式及名称:________.
(4).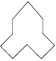 的名称是________.
的名称是________.
(5)写出下列有机物的结构简式.
①环戊烯:________________
②3-甲基-1-丁炔:___________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com