
| AB | CD | EF | |
| 离子电荷数 | 1 | 1 | 2 |
| 键长(10-10 m) | 2.31 | 3.18 | 2.10 |
| A、CD>AB>EF |
| B、AB>EF>CD |
| C、AB>CD>EF |
| D、EF>AB>CD |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、②③④ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Li Na K |
| B、Na Mg Al |
| C、Li Be Mg |
| D、Li Na Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、晶体熔点由低到高:CF4<CCl4<CBr4<CI4 |
| B、硬度由大到小:金刚石>碳化硅>晶体硅 |
| C、熔点由高到低:Al>Mg>Na |
| D、晶格能由大到小:NaI>NaBr>NaCl>NaF |
查看答案和解析>>
科目:高中化学 来源: 题型:
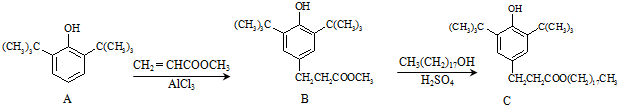
| A、物质A中所有碳原子有可能位于同一平面 |
| B、物质B不能发生取代反应 |
| C、用酸性KMnO4溶液鉴别抗氧化剂C中是否含有CH3(CH2)17OH |
| D、1mol抗氧剂C与足量NaOH溶液反应,最多可消耗2mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、羟基的电子式: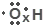 | ||
B、14C的原子结构示意图: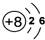 | ||
C、质子数为6、质量数为14的原子:
| ||
| D、熔融状态下硫酸氢钾的电离方程式:KHSO4→K++H++SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com