
 航天发射的运载火箭常用燃料肼(N2H4)和强氧化剂过氧化氢,火箭部分构件采用钛合金材料,回答下列问题:
航天发射的运载火箭常用燃料肼(N2H4)和强氧化剂过氧化氢,火箭部分构件采用钛合金材料,回答下列问题:| 熔点/K | 沸点/K | 水中溶解度(标准状况下) | |
| H2S | 187 | 202 | 每升水中溶解2.6L |
| H2O2 | 272 | 423 | 以任意比互溶 |
分析 (1)非金属性越强,第一电离能越大,氮元素原子2p能级为半满稳定状态,第一电离能高于氧元素的;N2H4分子含有4个N-H键、1个N-N键;
(2)Ti原子核外电子数为22,根据能量最低原理书写核外电子排布式;
(3)H2O分子中O原子形成2个O-H键,含有2对孤对电子,杂化轨道数目为4;H2O2的分子之间形成氢键,沸点高于硫化氢的,H2O2与H2O分子之间也可以形成氢键;
(4)离子所带电荷相等,离子半径越小晶格能越大;
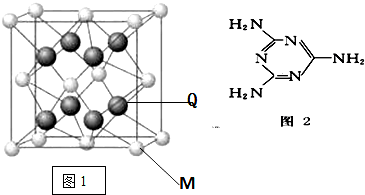
(5)根据均摊法计算晶胞中N、B原子数目,B原子配位数为4,原子的配位数与原子数目成反比,表示出晶胞质量,再根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:(1)非金属性越强,第一电离能越大,氮元素原子2p能级为半满稳定状态,第一电离能高于氧元素的,故第一电离能N>O>H,N2H4分子含有4个N-H键、1个N-N键,1molN2H4分子中所含σ键的数目为5NA,
故答案为:N;5NA;
(2)Ti原子核外电子数为22,核外电子排布式为:1s22s22p63s23p63d24s2,3d轨道的2个电子为单电子,
故答案为:1s22s22p63s23p63d24s2;2;
(3)H2O分子中O原子形成2个O-H键,含有2对孤对电子,空间构型为V形,杂化轨道数目为4,O原子采取sp3杂化,H2O2的分子之间形成氢键,沸点高于硫化氢的,H2O2与H2O分子之间也可以形成氢键,H2O2在水中的溶解度大于H2S的,
故答案为:V形;sp3杂化;H2O2的分子之间形成氢键,沸点高于硫化氢的,H2O2与H2O分子之间也可以形成氢键,H2O2在水中的溶解度大于H2S的;
(4)离子所带电荷相等,镁离子半径小于钙离子半径,故MgO的晶格能大于CaO的晶格能,
故答案为:大于;镁离子半径小于钙离子半径;
(5)晶胞中N原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、B原子数目为4,二者原子数目为1:1,B原子配位数为4,则N原子配位数也是4,晶胞质量为4×$\frac{11+14}{{N}_{A}}$g,则晶胞密度=4×$\frac{11+14}{{N}_{A}}$g÷(a cm)3=$\frac{100}{{a}^{3}{N}_{A}}$g•cm-3,
故答案为:4;$\frac{100}{{a}^{3}{N}_{A}}$.
点评 本题是对物质结构与性质的考查,涉及电离能、核外电子排布、杂化方式与空间构型判断、分子结构与性质、晶格能、晶胞计算等,注意同周期第一电离能异常情况、氢键对物质性质的影响.


科目:高中化学 来源: 题型:解答题
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为提高反应速率和原料利用率,硫铁矿要在“沸腾”状态下燃烧 | |
| B. | 为防止催化剂中毒,气体在进接触室前要先净化 | |
| C. | 接触室中热交换器的主要作用是预热未反应的气体和冷却反应后的气体 | |
| D. | 吸收塔中SO3从下而上,水从上而下喷,剩余气体从上部出来循环利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 压强Mpa 转化率% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LN2中含有π健数为3NA | |
| B. | 12g金刚石中含有C-C键数为4NA | |
| C. | 25℃时,pH=12的CH3COONa溶液中水电离出的OH-的数目为0.01NA | |
| D. | 当反应3(NH4)2SO4$\frac{\underline{\;\;△\;\;}}{\;}$4NH3↑+3SO2↑+N2↑+6H2O生成89.6L标准状况的气体时,转移的电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③④ | C. | ②③⑤ | D. | ②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com