
| A、32 g O2占有的体积约为22.4 L |
| B、22.4 L N2含阿伏加德罗常数个氮分子 |
| C、在标准状况下,22.4 L水的质量约为18 g |
| D、22 g二氧化碳与标准状况下11.2 L HCl约含有相同的分子数 |
| m |
| M |
| V |
| Vm |
| 22g |
| 44g/mol |
| 11.2L |
| 22.4L/mol |


科目:高中化学 来源: 题型:
| A、同质量、不同密度的N2和C2H4 |
| B、同温度、同体积的H2和N2 |
| C、同体积、同密度的CO和N2 |
| D、同压强、同体积的N2O和CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
c[Cu(NH3
| ||
| c(Cu2+)?c4(NH3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
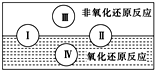 Ⅰ.已知水是人体的重要组成部分,是人体中含量最多的一种物质.而“四种基本反应类型与氧化还原反应的关系”也可用右图表达:请写出有水参加的符合反应类型Ⅳ的一个化学方程式:
Ⅰ.已知水是人体的重要组成部分,是人体中含量最多的一种物质.而“四种基本反应类型与氧化还原反应的关系”也可用右图表达:请写出有水参加的符合反应类型Ⅳ的一个化学方程式:
| ||
4- 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(X)=0.03 mol/(L?min) |
| B、v(Y)=0.02 mol/(L?min) |
| C、v(Z)=0.10 mol/(L?min) |
| D、v(w)=0.20 mol/(L?min) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
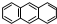 分子式C14H10)反应生成蒽醌(
分子式C14H10)反应生成蒽醌(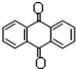 分子式C14H8O2),反应式为(未配平)C14H10(蒽)+KMnO4+H2SO4→C14H8O2(蒽醌)+K2SO4+MnSO4+H2O.
分子式C14H8O2),反应式为(未配平)C14H10(蒽)+KMnO4+H2SO4→C14H8O2(蒽醌)+K2SO4+MnSO4+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:

| A、若甲为恒容体系,图象(Ⅰ)代表温度不同时,时间与B的体积分数关系图,则m>0 |
| B、恒温条件下,图象 (Ⅰ)可能代表压强不同时,时间与B的体积分数关系图 |
| C、恒温条件下,若甲、乙两容器体积相同,起始时分别向甲中充入2molA,乙中充入1molB、3molC,则达到平衡后两容器中B的体积分数一定不同 |
| D、恒温条件下,乙容器存在图象 (Ⅱ)的关系,则当x代表压强时,y可代表B的体积分数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com