
| A. | 乙烯的结构简式为CH2CH2 | B. | 羟基的电子式: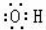 | ||
| C. | Ca2+的结构示意图为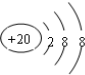 | D. | 乙醇的分子式:CH3CH2OH |
分析 A.结构简式中需要标出乙烯的官能团结构;
B.羟基为中性原子团,氧原子最外层含有7个电子;
C.钙离子的核电荷数为20,核外电子总数为18,最外层满足8电子稳定结构.
D.分子式只表示分子中含有元素种类及数目,不需要标出官能团结构.
解答 解:A.乙烯分子中含有碳碳双键,其正确的结构简式为:CH2=CH2,故A错误;
B.羟基中含有1个O-H键,氧原子最外层电子数为7,其正确的电子式为 ,故B错误;
,故B错误;
C.Ca2+的核外电子总数为18,其离子结构示意图为: ,故C正确;
,故C正确;
D.CH3CH2OH为乙醇的结构简式,乙醇的分子式为:C2H6O,故D错误;
故选C.
点评 本题考查了常见化学用语的表示方法判断,题目难度中等,涉及离子结构示意图、电子式、结构简式、分子式等知识,明确常见化学用语的概念及书写原则为解答结构,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,16 g O2和32g O3的混合物中,含有O原子数目为3NA | |
| B. | 标准状况下,1 mol Na2O和1 mol Na2O2的混合物中,含有离子总数为7NA | |
| C. | 1 mol NaBH4中离子键的数目为2NA | |
| D. | 在K35ClO3+6H37Cl═KCl+3Cl2↑+3H2O中,若生成71 g Cl2,转移的电子数目为$\frac{5}{3}$NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
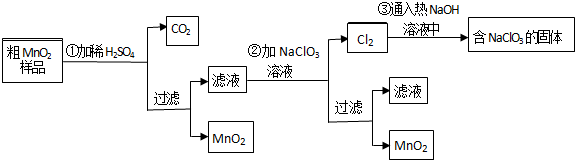
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
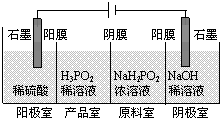 次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
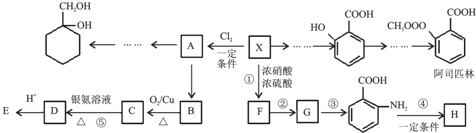
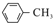 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$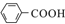
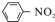 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$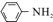 (苯胺,易被氧化)
(苯胺,易被氧化) ,分子中最多有13个原子共面.
,分子中最多有13个原子共面. .
. .
.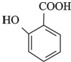 有多种同分异构体,试写出所有苯环上含有1个醛基和2个羟基,且核磁共振氢谱显示为4组峰的芳香族化合物的结构简式
有多种同分异构体,试写出所有苯环上含有1个醛基和2个羟基,且核磁共振氢谱显示为4组峰的芳香族化合物的结构简式 .
.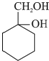 最合理的方案.在合成路线流程图的方框中填出相应的物质,并在括号注明反应条件.
最合理的方案.在合成路线流程图的方框中填出相应的物质,并在括号注明反应条件.
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
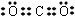 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L乙醇含有2NA个碳子 | |
| B. | 常温常压下,17g羟基含有9NA个电子 | |
| C. | 28g乙烯和丙烯(C3H6)的混合气体中含有的碳原子数为2NA | |
| D. | 1molNa被完全氧化生成Na2O2,失去NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极质量不变 | B. | 电流通过导线由铜片流向银片 | ||
| C. | 烧杯中Ag+浓度逐渐减小 | D. | 电池工作时,铜片失电子,被还原 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一上第一次月考化学卷(解析版) 题型:选择题
一定物质的量浓度的NaCl、MgCl2、AlCl3三种溶液与同体积同浓度的AgNO3完全反应,消耗三溶液的体积比为3:2:1,则三种溶液中Cl-的物质的量浓度之比为
A.1:1:1 B.1:2:3 C.3:2:1 D.2:3:6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com