在体积为VL的干燥烧瓶中,用排空气法充入HCl气体后,测得瓶中气体对O2的相对密度为1.082,此气体进行喷泉实验,喷泉停止后,进入烧瓶的体积是( )
A.0.25VL
B.0.5VL
C.0.75VL
D.VL
【答案】
分析:根据瓶中气体对O
2的相对密度为1.082计算混合气体的平均相对分子质量,根据相对分子质量计算混合气体中氯化氢的体积,进入水的体积即为氯化氢的体积.
解答:解:由n=

可知,
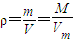
,在相同条件下气体的相对分子质量之比等于密度之比,
瓶中气体对O
2的相对密度为1.082,则混合气体的平均相对分子质量为1.082×32=34.624,
设混合气体中含有xmol空气,ymol氯化氢,
则有:

=34.624,
x:y=1:3,
根据阿伏加德罗定律可知,在相同条件下气体的物质的量之比等于气体的体积之比,
混合气体中氯化氢的体积为
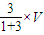
L=0.75VL,
故选C.
点评:本题考查阿伏加德罗定律定律及其推论,题目难度中等,解答本题的关键是在相同条件下气体的相对分子质量之比等于密度之比,根据相对密度计算混合气体的平均相对分子质量,进而计算混合气体的体积比.

 可知,
可知,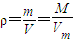 ,在相同条件下气体的相对分子质量之比等于密度之比,
,在相同条件下气体的相对分子质量之比等于密度之比, =34.624,
=34.624,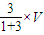 L=0.75VL,
L=0.75VL,
