
【题目】设NA表示阿伏加德罗常数的值,下列判断正确的是( )
①. 标准状况下,22.4LSO3中含有的原子数目为4NA
② 在常温常压下,48g 氧气和臭氧的混合气体含氧原子数是3NA
③1molCl2参加反应转移电子数一定为2NA
④ lmolNa2O2 与水充分反应转移的电子数为2NA
⑤ 0.1mol/L BaCl2溶液中Cl-数目是0.2 NA
⑥ 4℃时,22.4 L水中含有的电子数目为 10 NA个
⑦ 使2.3g钠变为 Na+,需失去0.1NA个电子
⑧ 10g46%乙醇水溶液中所含氢原子数目为0.6NA
A. ①②③⑧ B. ②③⑦⑧ C. ②⑦ D. 全部
【答案】C
【解析】
①标准状况下三氧化硫不是气体,22.4LSO3中含有的原子数目不是4NA,①错误;
②氧气和臭氧均是氧元素形成的不同单质,在常温常压下,48g氧气和臭氧的混合气体中氧原子的物质的量是48g÷16g/mol=3mol,含氧原子数是3NA,②正确;
③1molCl2参加反应转移电子数不一定为2NA,例如与氢氧化钠溶液反应时转移1mol电子,③错误;
④lmolNa2O2与水时过氧化钠既是氧化剂,也是还原剂,则充分反应转移的电子数为NA,④错误;
⑤0.1mol/L BaCl2溶液的体积未知,不能计算其中Cl-数目,⑤错误;
⑥4℃时,22.4 L水的物质的量不是1mol,含有的电子数目不是10NA个,⑥错误;
⑦使2.3g钠即0.1mol钠变为Na+,需失去0.1NA个电子,⑦正确;
⑧10g46%乙醇水溶液中所含氢原子的物质的量是![]() =1.2mol,因此氢原子数目为1.2NA,⑧错误;
=1.2mol,因此氢原子数目为1.2NA,⑧错误;
答案选C。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】中华诗句华丽优美且富含哲理,古人常将化学知识融入诗句中,以下诗句包含化学变化的是( )
A.千锤万凿出深山B.女娲炼石补天处
C.吹尽狂沙始到金D.多少楼台烟雨中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、生活密切相关,下列有关说法中不正确的是
A.硅胶多孔,常用作食品干燥剂
B.氨易液化,常用作制冷剂
C.飞机播撒AgI是实现人工降雨的一种方法
D.为了防止蛋白质盐析,疫苗等生物制剂应冷冻保藏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲用含有少量氯化钙的氯化钠固体,配制100 mL 1mol·L-1的氯化钠溶液,设计了下面的操作方案。根据方案操作步骤回答下列问题:
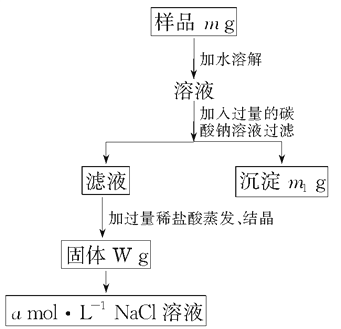
(1)称量粗盐样品m g,所用仪器名称为:_____________。
(2)过滤时,玻璃棒的作用是:__________________。
(3)蒸发操作时应将液体放在__________中加热,等加热至________时即停止加热。
(4)在样品的溶液中加入过量的Na2CO3溶液,作用是__________________,反应的化学方程式是______________________________________。
(5)在滤液中加入盐酸的作用是____________________________________,
反应的离子程式是_______________________________________。
(6)配制100 mL 1 mol·L-1的NaCl溶液时,应从W g固体中称取NaCl的质量为________,配制时应在________中进行定容。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,下列说法不正确的是( )
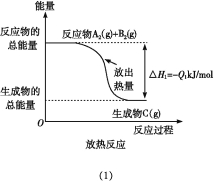

A.反应过程(1)的热化学方程式为A2(g)+B2(g)C(g)ΔH1=-Q1 kJ/mol
B.反应过程(2)的热化学方程式为C(g)A2(g)+B2(g)ΔH2=+Q2 kJ/mol
C.Q1与Q2的关系:Q1>Q2
D.ΔH2>ΔH1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用右图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 | 实验装置 |
A | 稀硫酸 | Na2S | AgNO3与AgCl的溶液 | Ksp(AgCl)>Ksp(Ag2S) |
|
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟在自然界中常以CaF2的形式存在。
(1)下列关于CaF2的表述正确的是_____。
a.Ca2+ 与F﹣间仅存在静电吸引作用
b.F﹣的离子半径小于Cl﹣,则CaF2的熔点高于CaCl2
c.阴阳离子比为2∶1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
(2)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是 _____________________(用离子方程式表示)。
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为_____,其中氧原子的杂化方式为____。
(4)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)═2ClF3(g)△H=﹣313kJmol﹣1,F﹣F键能159kJmol﹣1,Cl﹣Cl键的键能为242kJmol﹣1,则ClF3中Cl﹣F键的平均键能为________ kJmol﹣1,ClF3的熔、沸点比BrF3的_____(填“高”或“低”)。
(5)如图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体的结构示意图,请回答下列问题:
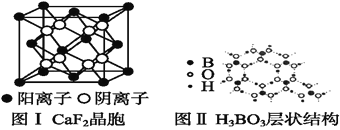
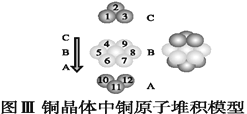
①图Ⅰ所示的CaF2晶胞中与Ca2+最近且等距离的F-数为____,图Ⅲ中未标号的铜原子形成晶体后周围最紧邻的铜原子数为____。
②图Ⅱ所示的物质结构中最外层已达8电子结构的原子是____。H3BO3晶体中B原子个数与极性键个数比为____。
③三种晶体中熔点最低的是____,其晶体受热熔化时,克服的微粒之间的相互作用力为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于1L H2SO4和HNO3的混合溶液,若H2SO4和HNO3物质的量浓度存在如下关系:c(H2SO4)+c(HNO3)=1.2mol/L,则理论上最多能溶解铜的物质的量为
A. 0.40mol B. 0.45mol C. 0.72mol D. 0.80mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氨可以与灼热的氧化铜反应得到氮气、金属铜和一种氧化物。用下图装置可以实现该反应。

回答下列问题:
(1)A 中发生反应的化学方程式是_____;
(2)B 中加入的物质是____;
(3)实验时在 C 中观察到的现象是______, 发生反应的化学方程式是_______;
(4)实验时在 D 中观察到的现象是出现无色液体,D 中收集到的物质是____,检验该 物质的方法和现象是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com