
| A. | 胶体区别于其他分散系的本质特征是分散质的微粒直径在1nm~100nm之间 | |
| B. | 用平行光照射CuSO4溶液和Fe(OH)3胶体,可以加以区分 | |
| C. | 把FeCl3饱和溶液滴入到NaOH溶液中,以制取Fe(OH)3胶体 | |
| D. | 树林中的晨曦,该现象与丁达尔效应有关 |
分析 A.胶体区别于其他分散系的本质特征是分散质的微粒直径;
B.丁达尔效应可用于区分溶液和胶体;
C.制备氢氧化铁胶体,应在沸水中滴加饱和氯化铁溶液;
D.树林中的晨曦形成胶体分散系,胶体具有丁达尔现象.
解答 解:A.胶体区别于其他分散系的本质特征是分散质的微粒直径,胶体的分散质的微粒直径在1nm~100nm之间,故A正确;
B.丁达尔效应可用于区分溶液和胶体,溶液无丁达尔效应,胶体有丁达尔效应,故B正确;
C.制备氢氧化铁胶体,应在沸水中滴加饱和氯化铁溶液,向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,生成氢氧化铁沉淀,故C错误;
D.因树林中的晨曦形成胶体分散系,图片显示胶体具有丁达尔现象,故D正确.
故选C.
点评 本题考查胶体的性质,要求学生熟记教材中提到的胶体的例子,是对基础内容的考查,难度不大.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1molZn与含0.1molHCl的盐酸充分反应,转移的电子数目为0.2NA | |
| B. | 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA | |
| C. | 1molNa2O2与足量CO2充分反应转移的电子数为2NA | |
| D. | 向FeI2溶液中通入适量Cl2,当有1molFe2+被氧化时,共转移的电子的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,22.4LH2O含有的分子数为1 NA | |
| B. | 常温常压下,22g CO2含有原子数1.5NA | |
| C. | 32g 氧气和臭氧的混合气体中含有氧原子的个数为2NA | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E是原子序数依次递减的五种常见元素.C元素是地壳中含量最多的元素,D、E组成的气态化合物M的水溶液呈碱性,B的单质在C2中燃烧产物可使品红溶液褪色,A是一种历史悠久、应用广泛的金属元素.请回答:
A、B、C、D、E是原子序数依次递减的五种常见元素.C元素是地壳中含量最多的元素,D、E组成的气态化合物M的水溶液呈碱性,B的单质在C2中燃烧产物可使品红溶液褪色,A是一种历史悠久、应用广泛的金属元素.请回答: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(NO3)2、CaCl2 分别与 Na2CO3 反应 | |
| B. | Ba(OH)2、BaCl2 分别与H2SO4 反应 | |
| C. | Na2CO3、BaCO3分别与盐酸反应 | |
| D. | NaOH、Cu(OH)2分别与盐酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮气的电子式: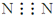 | |
| B. | 乙酸乙酯的结构简式:C4H8O2 | |
| C. | O2-的结构示意图: | |
| D. | 氢氧化钡的电离方程式:Ba(OH)2═Ba2++(OH-)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com