
| A. | 化石燃料燃烧和工业废气中的氮氧化物均是导致“雾霾天气”的元凶 | |
| B. | 天津港爆炸事件中可知,当电石、钠、氰化钠等物品遇到明火时,应迅速用水浇灭 | |
| C. | 新发现一种固态碳,外形似海绵,密度小,有磁性,其与金刚石的关系是同素异形体 | |
| D. | 热的纯碱溶液去除厨房油污效果比冷的纯碱溶液效果好 |
分析 A.化石燃料燃烧和工业废气中的氮氧化物均是导致“雾霾天气”的原因之一;
B.电石能与水反应生成乙炔,钠能与水反应生成氢气;
C.同一元素形成的不同单质互称同素异形体;
D.温度升高有利于水解平衡正向移动来分析碳酸根的水解平衡.
解答 解:A.导致“雾霾天气“的原因有多种,化石燃料燃烧和工业废气中的氮氧化物均是导致“雾霾天气”的原因之一,故A正确;
B.电石能与水反应生成乙炔,钠能与水反应生成氢气,不能用水灭火,故B错误;
C.固态碳与金刚石都是碳元素形成的不同单质,所以互为同素异形体,故C正确;
D.温度升高,有利于碳酸根的水解平衡正向移动,生成的氢氧根浓度越大,碱性越强,酯的水解越彻底,去油污效果好,故D正确.
故选B.
点评 本题考查化学与生产、生活的关系,题目难度不大,要求学生能够用化学知识解释化学现象,试题培养了学生的分析、理解能力及灵活应用基础知识的能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3H2S+2NO3-+2H+═2NO↑+3S↓+4H2O | |
| B. | 3Fe3++3NO3-+6H2S═3NO↑+6S↓+3Fe2++6H2O | |
| C. | Fe3++3NO3-+5H2S+2H+═3NO↑+5S↓+Fe2++6H2O | |
| D. | Fe3++9NO3-+14H2S+8H+═9NO↑+14S↓+Fe2++18H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将大理石投入到足量盐酸中:CO32-+2H+═CO2↑+H2O | |
| B. | 铁钉放入硫酸铁溶液中:Fe+Fe3+═2Fe2+ | |
| C. | 向AlCl3溶液中加入过量的氨水反应:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 将稀硫酸滴入氢氧化钡溶液中:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuO做氧化剂 | B. | Cu做还原剂 | ||
| C. | 铜是氧化产物 | D. | 铜元素化合剂升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠在用小刀切割后,剩余的钠应放回煤油中 | |
| B. | 焰色反应实验前,铂丝应先用盐酸洗涤后灼烧至无色,焰色反应是一种物理变化 | |
| C. | 实验室制备氢氧化亚铁时,滴加氢氧化钠溶液的胶头滴管伸入液面下 | |
| D. | 将烧碱溶液保存在磨口的细口玻璃瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
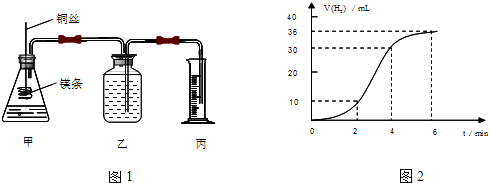
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
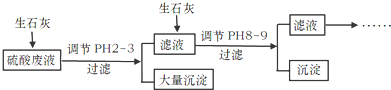
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com