
亚硝酸钠是一种工业盐,外观与食盐非常相似,毒性较强。
Ⅰ.经查:①Ksp(AgNO2)=2×10-8,Ksp(AgCl)=1.8×10-10;②Ka(HNO2)=5.1×10-4。请设计最简单的方法鉴别NaNO2和NaCl两种固体______________________
Ⅱ. 某小组同学用如下装置(略去夹持仪器)制备亚硝酸钠

已知:①2NO+Na2O2=2NaNO2; ②酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+。
(1)使用铜丝的优点是________________________。
(2)装置A中发生反应的化学方程式为_____________________________。
装置C中盛放的药品是_________;(填字母代号)
A.浓硫酸 B.NaOH溶液 C.水 D.四氯化碳
(3)该小组称取5.000g制取的样品溶于水配成250ml溶液,取25.00ml溶液于锥形瓶中,
用0.1000mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积/mL | 20.90 | 20.12 | 20.00 | 19.88 |
①第一次实验数据出现异常,造成这种异常的原因可能是_________(填字母代号)。
a.锥形瓶洗净后未干燥
b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定终点时仰视读数
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式为___________________。
③该样品中亚硝酸钠的质量分数为______________。
科目:高中化学 来源:2016-2017学年湖南省益阳市高二下学期3月月考化学试卷(解析版) 题型:选择题
下列描述 分子结构的叙述中,正确的是
分子结构的叙述中,正确的是
A.最多有6个碳原子在一条直线上 B.该烃属于苯的同系物
C.至少有10个碳原子在同一平面上 D.所有碳原子不可能都在同一平面上
查看答案和解析>>
科目:高中化学 来源:2017届四川省广元市高三第二次高考适应性统考理综化学试卷(解析版) 题型:选择题
下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 等体积pH=2的HX和HY两种酸分别与足量的铁反应,用排水法收集气体 | HX放出的氢气多且反应速率快 | HX酸性比HY强 |
B | 向2mL0.1mol/LNa2S溶液中滴2滴0.1mol/LZnSO4溶液;再滴2滴0.1mol/LCuSO4 | 先生成白色沉淀,后生成黑色沉淀 | 溶解度(Ksp):ZnS>CuS |
C | 在稀硫酸中加入铜,再加入硝酸钠固体 | 开始无现象,后铜逐步溶解,溶液变蓝,有气泡产生 | 硝酸钠可以加快铜与稀硫酸的反应速率 |
D | 将一铝箔放在酒精灯外焰上灼烧 | 铝箔熔化但不滴落 | 铝箔表面生成致密的Al2O3薄膜,且Al2O3熔点高于Al |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二下学期月考(一)化学试卷(解析版) 题型:选择题
观察下列模型并结合有关信息, 判断有关说法正确的是
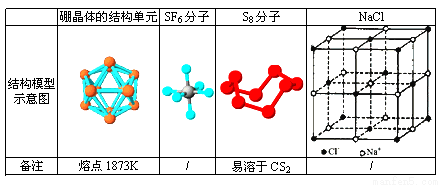
A. 单质硼属分子晶体,其结构单B12中含有30个B-B键,含20个正三角形
B. SF6是由极性键构成的分子
C. 固态硫S8属于原子晶体
D. NaCl晶体中每个Na+周围距离最近的Na+有6个
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二下学期月考(一)化学试卷(解析版) 题型:选择题
下列说法正确的是
A. HCl、HBr、HI的分子间作用力依次增大,热稳定性也依次增强
B. N2和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构
C. 在O2、CO2和SiO2中,都存在共价键,它们均由分子构成
D. KOH和MgCl2都是离子晶体,均在共价键和离子键
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省桂林市高一下学期开学考化学试卷(解析版) 题型:选择题
在标准状况下,将某X气体V L溶于水中,得到12mol·L-1的溶液500mL,则气体的体积V是( )
A.134.4L B.67.2L C.44.8L D.537.6L
查看答案和解析>>
科目:高中化学 来源:2017届云南省高三下学期第一次统测理综化学试卷(解析版) 题型:简答题
五种短周期元素X、Y、Z、W、Q的原子序数依次增。X、Y是非金属元素X、Y、Q元素的原子最高能级上电子数相等;Z元素原子的最外层电子数是次外层的两倍;W元素原子核外有三种不同的能级且原子中p亚层与s亚层电子总数相等;Q元素电离能分别是I1=496,I2=4562,I3=6912。回答下列问题:
(1)基态Q原子的核外电子排布式是____________________。
(2)Q、W形成的化合物Q2W2中的化学键类型是______________。
(3)Y能与氟元素形成YF3,该分子的空间构型是_______,该分子属于______分子(填“极性”或“非极性”)。Y与X可形成具有立体结构的化合物Y2X6,该结构中Y采用______杂化。
(4)Y(OH)3是一元弱酸,其中Y原子因缺电子而易形成配位键,写出Y(OH)3在水溶液中的电离方程式_______________。
(5) Z的一种单质晶胞结构如下图所示。
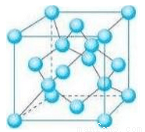
①该单质的晶体类型为___________。
②含1 mol Z原子的该晶体中共有_____mol化学键。
③己知Z的相对原子质量为M,原子半径为r pm,阿伏伽德罗常数的值为NA,则该晶体的密度为____g·cm-3。
查看答案和解析>>
科目:高中化学 来源:2017届广西省桂林市、崇左市高三联合调研考试理科综合化学试卷(解析版) 题型:选择题
下列实验能达到相应目的的是
A. 用乙醇萃取溴水中的溴单质
B. 用干燥的pH试纸测定新制氯水的pH
C. 向NH4Cl溶液中滴加石蕊试液,溶液变红,证明NH4Cl发生了水解反应
D. 向蒸馏水中滴加过量的饱和FeCl3溶液,并不断搅拌,制取Fe(OH)3胶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com