
| A. | 2gD2O与2gH218O含有的中子数均为NA | |
| B. | 1L0.1mol•L-1Na2S溶液中S2-和H2S的数目之和为0.1NA | |
| C. | 漂白粉中加入浓盐酸,每生成1molCl2,转移的电子数2NA | |
| D. | 常温下,将1molNO2气体加压生成N2O4的分子数为0.5NA |
分析 A.D2O与H218O分子中都含有10个中子,其摩尔质量都是20g/mol;
B.硫离子水解生成硫氢根离子,硫氢根离子水解生成硫化氢;
C.依据方程式Ca(ClO)2+4HCl(浓)→CaCl2+2Cl2↑+2H2O解答;
D.二氧化氮生成四氧化二氮为可逆反应,依据可逆反应不能进行到底特点解答.
解答 解:A.2gD2O与2gH218O物质的量都是0.1mol,含有的中子物质的量都是1mol,个数均为NA,故A正确;
B.硫离子水解生成硫氢根离子,硫氢根离子水解生成硫化氢,依据硫原子个数守恒可知,1L0.1mol•L-1Na2S溶液中S2-和H2S的数目之和小于0.1NA,故B错误;
C.依据方程式Ca(ClO)2+4HCl(浓)→CaCl2+2Cl2↑+2H2O可知,生成2mol氯气,盐酸失去2mol电子需要2mol盐酸作还原剂,生成1mol氯气,所以其转移电子数是NA,故C错误;
D.二氧化氮生成四氧化二氮为可逆反应,依据可逆反应不能进行到底,则1molNO2气体加压生成N2O4的分子数小于0.5NA,故D错误;
故选:A.
点评 本题考查阿伏加德罗常数的有关计算和判断,明确盐类水解规律、氧化还原电得失电子守恒规律、可逆反应特点是解题关键,题目难度中等.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:选择题
| A. | 煤是无机化合物,天然气和石油是有机化合物 | |
| B. | 利用化石燃料燃烧放出的热量使分解产生氢气,是氢能开发的研究方向 | |
| C. | 化学电源放电、植物光合作用都能发生化学变化,并伴随能量的转化 | |
| D. | 若化学过程中断开化学键放出的能量大于形成化学键所吸收的能量,则反应放热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 操作 | |
| A | 欲证明CH2=CHCHO中含有碳碳双键 | 滴入酸性KMnO4溶液 |
| B | 欲除去苯中混有的苯酚 | 向混合液中加入浓溴水,充分反应后,过滤 |
| C | 证明SO2具有漂白性 | 将SO2通入酸性KMnO4溶液中 |
| D | 确定碳和硅两元素非金属性强弱 | 测同温同浓度Na2CO3和Na2SiO3水溶液的pH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上生产玻璃、水泥、漂白粉均需要用石灰石为原料 | |
| B. | 用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同 | |
| C. | 大分子化合物油脂在人体内水解为氨基酸和甘油等小分子才能被吸收 | |
| D. | 司母戊鼎、定远舰甲板、有机玻璃等原材料属于合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
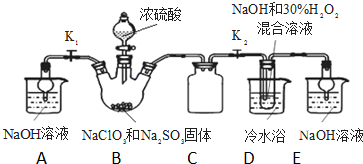 亚氯酸钠(NaClO2)是重要漂白剂.探究小组开展如下实验,回答下列问题:
亚氯酸钠(NaClO2)是重要漂白剂.探究小组开展如下实验,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
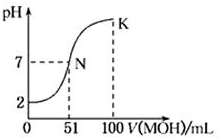 常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1的MOH溶液,图中所示曲线表示混合溶液的pH变化情况.下列说法中正确的是( )
常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1的MOH溶液,图中所示曲线表示混合溶液的pH变化情况.下列说法中正确的是( )| A. | HA为一元强酸,MOH为一元弱碱 | |
| B. | 滴入MOH溶液的体积为50 mL时,c(M+)>c(A-) | |
| C. | N点水的电离程度大于K点水的电离程度 | |
| D. | K点时,c(MOH)+c(M+)=0.02 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y形成的两种化合物中阴阳离子个数比为1:2 | |
| B. | Y分别与Z、W、R以两种元素组成的常见化合物有5种 | |
| C. | Y的氢化物比R的氢化物稳定,Y的氢化物熔沸点比R的氢化物熔沸点低 | |
| D. | Z、W、R的最高价氧化物对应水化物的酸性强弱顺序是R>W>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
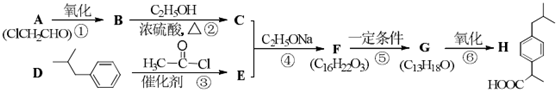
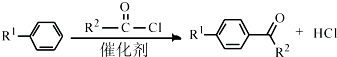 (R1、R2代表烷基)
(R1、R2代表烷基)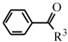 +ClCH2COOR4+R4ONa→
+ClCH2COOR4+R4ONa→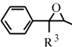 COOR4+R4OH+NaCl(R3、R4代表烷基)
COOR4+R4OH+NaCl(R3、R4代表烷基)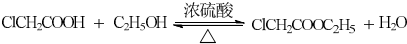 .
. .
.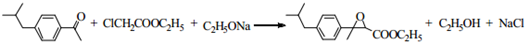 .
.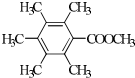 、
、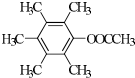 、
、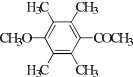 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
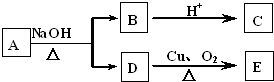 某有机物A的分子式为C6H12O2,已知A~E有如图转化关系,且D不与Na2CO3溶液反应,C、E均能发生银镜反应,则A的结构可能有( )
某有机物A的分子式为C6H12O2,已知A~E有如图转化关系,且D不与Na2CO3溶液反应,C、E均能发生银镜反应,则A的结构可能有( )| A. | 4种 | B. | 3种 | C. | 2种 | D. | 1种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com