
【题目】根据SO2通入不同溶液中的实验现象,所得结论不正确的是( )
溶液 | 现象 | 结论 | |
A | 含HCl,BaCl2的FeCl3溶液 | 产生白色沉淀 | SO2是酸性氧化物 |
B | H2S溶液 | 产生黄色沉淀 | SO2有氧化性 |
C | 酸性KMnO4溶液 | 紫色溶液褪色 | SO2有还原性 |
D | Na2SiO3溶液 | 产生胶状沉淀 | 酸性:H2SO3>H2SiO3 |
A.AB.BC.CD.D
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列实验所选择的装置或操作正确的是( )
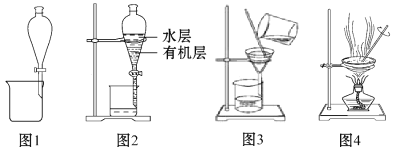
A.用图1所示的装置可以实现用酒精提取溴水中的Br2
B.用图2所示的装置分层时,两层液体先后从下口出
C.粗盐提纯,除去沉淀和泥沙等杂质时,选图3所示的装置
D.NaCl溶液蒸发结晶时,选图4所示的装置,至蒸发皿中晶体全部析出时再停止加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食用二氧化硫漂白过的食品,对人体的肝、肾脏等有严重损害。某科研小组设计实验检验二氧化硫的漂白性。回答下列问题:
(一)二氧化硫的制备
实验室一般采用亚硫酸钠与硫酸(浓硫酸与水1:1混合)反应制取二氧化硫
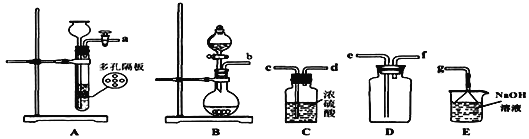
(1)写出实验室制SO2的化学方程式________________________________;
(2)欲收集一瓶干燥的二氧化硫,选择上图中的装置,其最佳连接顺序为:_______________________________________(按气流方向,用小写字母表示)。
(二)二氧化硫性质的检验
将上述收集到的SO2通入下列装置中,在一定温度下按图示装置进行实验。

(2)根据上述实验,回答下列问题:
序号 | 实验现象 | 解释原因 |
① | _________________________ | _________________________ |
② | 品红试液褪色 | SO2具有漂白性 |
③ | ________________________ | 反应的离子方程式____________________ |
④ | 溶液变浑浊,有黄色沉淀生成 | SO2+2H2S=3S↓+2H2O |
(3)用SO2漂白过的食品中一般残留有亚硫酸盐,科研小组设计了检验食品中是否含有亚硫酸盐的简单方法:将食品剪成碎末放入烧杯,加入适量的水,加热一会儿,冷却至室温,滴加盐酸和试剂A,观察液体的颜色变化既可。
①上述检验中试剂A是_____________。
②加热的作用是加快反应速率(或加快食品的溶解),加热时间不能太长的原因是_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的物质相互转化关系中,A是一种固体单质,E是一种白色不溶于水的物质。据此填空。
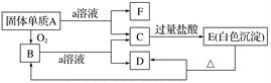
(1)写出各物质的化学式:
A.________、B________、C________、
D.________、E________、F________。
(2)B与a溶液反应的离子方程式是_________。
(3)A与a溶液反应的离子方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测得0.5 mol·L1CH3COONa溶液、0.5 mol·L1 CuSO4溶液以及H2O的pH随温度变化的曲线如图所示。下列说法正确的是

A. 随温度升高,纯水中c(H+)>c(OH)
B. 随温度升高,CH3COONa溶液的c(OH)减小
C. 随温度升高,CuSO4溶液的pH变化是Kw改变与水解平衡移动共同作用的结果
D. 随温度升高,CH3COONa溶液和CuSO4溶液的pH均降低,是因为CH3COO、Cu2+水解平衡移动方向不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,HA的电离常数Ka=1×10-6,向20 mL浓度为0.01 mol·L-1的HA溶液中逐滴加入0.01mol·L-1的NaOH溶液,溶液的pH与加入NaOH溶液的体积之间的关系如图所示,下列说法正确的是( )
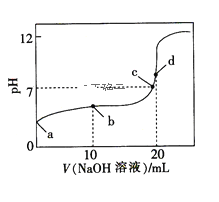
A.a点对应溶液的pH约为4,且溶液中只存在HA的电离平衡
B.b点对应溶液中:c(Na+)>c(A-)>c(HA)>c(H+)>c(OH-)
C.d点对应溶液中:c(OH-)-c(H+)=c(A-)
D.a、b、c、d四点对应的溶液中水的电离程度:a<b<c<d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组在20℃,101KPa下探究Cl2在蒸馏水和饱和食盐水中的溶解性。如图I、II所示,该小组用两支100mL注射器均吸入40mLCl2,然后分别吸入20mL蒸馏水和饱和食盐水,夹紧止水夹,充分振荡。下列说法正确的是( )
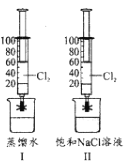
A.图I注射器中c(Cl-)约为0.09molL-1
B.图l注射器中n(ClO-)小于图II
C.图II注射器的活塞移动到20mL刻度处
D.图II注射器中存在NaCl(s)![]() Na+(aq)+Cl-(aq)
Na+(aq)+Cl-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2S是火法炼铜的重要原料之一,如图是由Cu2S冶炼铜及制取CuSO4·5H2O的流程图。
Cu2S![]() Cu
Cu![]() Cu2O、CuO
Cu2O、CuO![]() A
A![]() B
B![]() 胆矾
胆矾
(1)Cu2S中铜元素的化合价为___,火法炼铜的反应原理是__________(用化学方程式表示)。
(2)向Cu2O、CuO中加入足量稀硫酸得到的体系A中溶液呈蓝色,且有红色物质生成,请写出生成红色物质的离子方程式____________。
(3)若将A中红色物质反应掉,操作Ⅰ中加入的试剂最好是___(填字母序号)。
A.适量的NaNO3
B.适量的HNO3
C.适量的H2O2
(4)若B溶液的体积为0.2L,电解B溶液一段时间后溶液的pH由2变为1(体积变化忽略不计),此时电解过程中转移电子的物质的量是_____。
(5)取5.0g胆矾样品逐渐升高温度使其分解,分解过程的热重曲线如图所示。通过计算确定258℃时发生反应的化学方程式:____,e点对应物质的化学式为_____(计算过程略去)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有某铁碳合金,某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的还原产物,设计了如图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题:
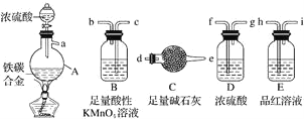
(1)该装置的连接顺序a___(填接口字母),连接好装置后,首先应进行的操作是____。
(2)mg铁碳合金中加入浓H2SO4,点燃酒精灯一段时间后,用滴管吸取A中的溶液滴入到适量水中作为试样,试样中所含金属离子的成分有以下三种可能:A:只含有Fe3+;B:只含有Fe2+;C:____,若为A,则A中反应的化学方程式为___,验证C种可能的实验方法___。
(3)待A中不再逸出气体时,停止加热,拆下C并称重,C增重bg。铁碳合金中铁的质量分数____(写表达式)。
(4)某同学认为利用此装置测得铁的质量分数偏大,请你写出可能的原因:_____。
(5)随着反应的进行,A中还可能发生某些离子反应。写出相应的离子方程式____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com