
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | ① | ||||||
| 二 | ② | ③ | ④ | ⑤ | ⑥ | ||
| 三 | ⑦ | ⑧ | ⑨ | ⑩ | |||
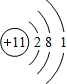 ,故答案为:
,故答案为: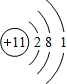 ;
;

 英才计划期末调研系列答案
英才计划期末调研系列答案 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:
| A、①② | B、①④ | C、②③ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
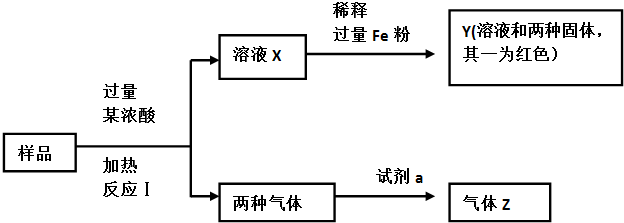
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 3 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5.1 g镁铝合金中含有镁、铝的质量分别为2.4 g、2.7 g |
| B、溶解5.1 g镁铝合金时,剩余盐酸的物质的量为0.1 mol |
| C、生成白色沉淀的最大质量为13.6 g |
| D、若白色沉淀只有Mg(OH)2,该NaOH溶液的物质的量浓度至少为1.2 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
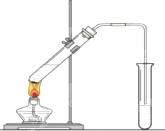 在实验室我们也可以用如图所示的装置制取乙酸乙酯.
在实验室我们也可以用如图所示的装置制取乙酸乙酯.查看答案和解析>>
科目:高中化学 来源: 题型:
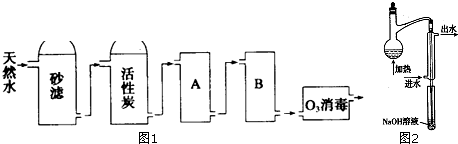
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、食用纤维素、淀粉、蛋白质、脂肪和植物油都是高分子化合物 |
| B、棉花和蚕丝的主要成份都是纤维素 |
| C、蔗糖、淀粉、油脂等都可以发生水解反应 |
| D、油脂都不能使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、反应在第4秒钟达到化学平衡状态,0~4秒内,以A表示的化学反应速率是 0.225 mol?L-1?s-1 |
| B、该温度下,压缩气体体积至1L,反应的平衡常数增大 |
| C、恒温条件下,缩小反应容器体积可以使反应的过程按图Ⅰ中a曲线进行 |
| D、在上述反应体系中加入催化剂,化学反应速率增大,则E1和E2均减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com