
科目:高中化学 来源: 题型:推断题
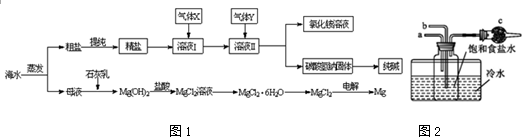
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L1mol/L的甲醇水溶液中含有氢原子总数为4NA | |
| B. | 50mL18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| C. | 反应KIO3+6HI═KI+3H2O+3I2中,生成3molI2转移电子的总数为5NA | |
| D. | 12g石墨和C60的混合物中质子总数为12NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
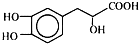
| A. | 丹参素在C上取代H的一氯代物有4种 | |
| B. | 在Ni催化下1 mol丹参素最多可与4 mol H2加成 | |
| C. | 丹参素能发生取代、消去、中和、氧化等反应 | |
| D. | 1 mol丹参素在一定条件下与足量金属钠反应可生成4 mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
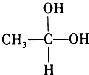 →CH3-CHO+H2O
→CH3-CHO+H2O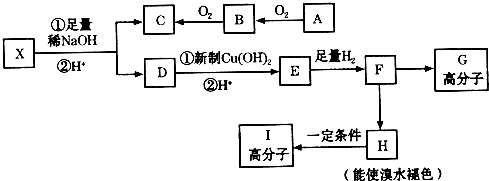
 .
. .
. .
.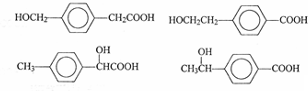 任意一种.
任意一种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
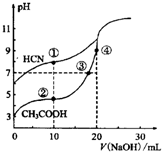
| A. | 点①和点②所示溶液中:c(CH3COO-)<c(CN-) | |
| B. | 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH) | |
| C. | 点③和点④所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| D. | 点②和点③所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
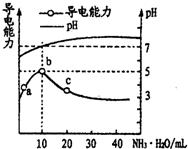
| A. | HR为强酸 | |
| B. | a、b、c三点所示溶液中水的电离程度相同 | |
| C. | b点溶液中c(NH4+)>c(R-)>c(OH-)>c(H+) | |
| D. | a~c任意点溶液均有c(H+)×c(OH-)=Kw=l.0×l0-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阿司匹林只有解热镇痛有作用,只能用于治疗感冒 | |
| B. | 青霉素是消炎药,有阻止多种细菌生长的优异功能.使用前一定要进行皮肤敏感试验 | |
| C. | 抗酸药能中和胃液中过多的盐酸,缓解胃部不适的症状 | |
| D. | 天然药物取自植物、动物和矿物,来源丰富,有广阔的开发前景 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
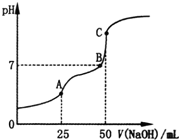
| A. | HC2O4-的电离程度大于其水解程度 | |
| B. | B点时溶液中含有Na2HC2O4和Na2C2O4 | |
| C. | C点时,c(Na+)>c(C2O42-)>c(HC2O4- )>c(OH-)>c(H+) | |
| D. | A点时,c(Na+)+c(H+)═c(OH-)+c(HC2O4-)+2c(C2O42-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com