
分析 ①碳酸氢钠加热分解生成碳酸钠;
②氯气氧化氯化亚铁生成氯化铁;
③Al能与强碱反应,而Mg不能与碱反应,再过滤分离;
④二氧化硫有还原性,能与酸性高锰酸钾反应生成硫酸;二氧化硫能与饱和的碳酸氢钠反应反应生成二氧化碳;
⑤Cu与稀硫酸不反应,可加入稀硫酸除去CuO.
解答 解:①由于碳酸氢钠加热分解生成碳酸钠,故可以加热方法除去混有的碳酸氢钠,故答案为:加热;
②氯气氧化氯化亚铁生成氯化铁,用氯气除去氯化铁溶液中混有的氯化亚铁,故答案为:Cl2;
③Al与NaOH溶液(或KOH溶液)反应反应,而Mg不能反应,再进行过滤分离,可以除去混有的Al,故答案为:NaOH溶液(或KOH溶液);
④二氧化硫有还原性,能与酸性高锰酸钾反应生成硫酸;二氧化硫能与饱和的碳酸氢钠反应反应生成二氧化碳,可以用KMnO4(H+)溶液(或饱和NaHCO3溶液)除去二氧化碳中混有的二氧化硫,故答案为:KMnO4(H+)溶液(或饱和NaHCO3溶液);
⑤Cu与稀硫酸不反应,可加入稀硫酸除去CuO,故答案为:稀硫酸.
点评 本题考查物质的分离、提纯,侧重于学生的分析能力、实验能力和评价能力的考查,难度不大,注意把握物质的性质的异同,注意除杂时不能引入新的杂质.


科目:高中化学 来源: 题型:解答题

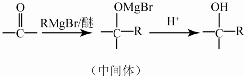
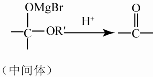
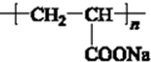

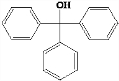 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 粒子 | Cu2+ | Fe2+ | Fe3+ |
| 开始沉淀时的pH | 4.7 | 5.8 | 1.9 |
| 完全沉淀时的pH | 6.7 | 9.0 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①③④ | B. | ⑤⑥⑦⑧ | C. | 只有②⑦ | D. | ①②④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
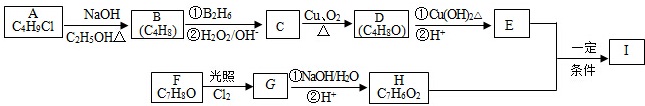
 +2Cl2$\stackrel{光照}{→}$
+2Cl2$\stackrel{光照}{→}$ +2HCl,该反应类型为取代反应.
+2HCl,该反应类型为取代反应. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 随着元素原子序数的递增,原子最外层电子数总是从1到8重复出现 | |
| B. | 元素的性质随着原子序数的递增而呈周期性变化 | |
| C. | 随着元素原子序数的递增,元素的最高正价从+1到+7,负价从-7到-1重复出现 | |
| D. | 主族元素原子的最高正价和负价的绝对值之和一定是8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
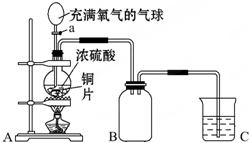 小明同学设计了如图所示装置来探究铜跟浓硫酸的反应.
小明同学设计了如图所示装置来探究铜跟浓硫酸的反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com