
【题目】高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g) ΔH = a kJ mol-1
2Fe(s)+3CO2(g) ΔH = a kJ mol-1
(1)已知: ①Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ΔH1 = + 489.0 kJ mol-1
②C(石墨)+CO2(g) = 2CO(g) ΔH2 = + 172.5 kJ mol-1
则a = kJ mol-1。
(2)冶炼铁反应的平衡常数表达式K = ,温度升高后,K值 (填“增大”、“不变”或“减小”)。
(3)在T℃时,该反应的平衡常数K=64,在2 L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
Fe2O3 | CO | Fe | CO2[ | |
甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
① 甲容器中CO的平衡转化率为 。
② 下列说法正确的是 (填字母)。
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO的平衡转化率大于乙的
c.甲、乙容器中,CO的平衡浓度之比为2∶3
d.增加Fe2O3可以提高CO的转化率
(4)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。
①在a~c装置中,能保护铁的是 (填字母)。
②若用d装置保护铁,X极的电极材料应是 (填名称)。

【答案】(1)-28.5 (2) C3(CO2)/ C3(CO) 减小
(3)① 60 % ② ac(漏选得1分,错选不得分)
(4)① bc(漏选得1分,错选不得分);② 锌
【解析】
试题分析:(1))①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJmol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJmol-1
由盖斯定律①-②×3得到Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g)△H=-28.5kJmol-1,故答案为:-28.5;-28.5 。(2)Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g)△H=-28.5kJmol-1,平衡常数K= C3(CO2)/ C3(CO) 反应是放热反应,升温平衡逆向进行,平衡常数减小 。
(3)①在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲中,加入物质反应达到平衡,设消耗一氧化碳物质的量为x
Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g)
起始量(mol) 1 1 1 1
变化量(mol) x x
平衡量(mol) 1-x 1+x
![]() ,计算得到x=0.6,转化率=60 % 。②a.反应前后气体质量变化,体积不变,若容器内气体密度恒定时,标志反应达到平衡状态,故a正确;b、反应前后气体体积相同,所以增加反应物的物质的量,等同于加压,平衡不移动,平衡转化率相同,故错误;c、甲容器中平衡一氧化碳物质的量为0.4mol;乙容器中结合平衡常数计算得到消耗一氧化碳为1.4mol,平衡物质的量为0.6mol,甲和乙容器中CO的平衡浓度之比为0.4+0.6=2:3,故正确;d、固体量增加不影响化学平衡,增加Fe2O3不能提高CO的转化率,故错误。故选 ac。(4)①a、铁做阳极,失去电子,故没有被保护;b、铁做阴极,被保护;c、铁做正极,被保护;故选bc。②保护铁,则让铁做原电池的正极,X活动性比铁强,可以为锌。
,计算得到x=0.6,转化率=60 % 。②a.反应前后气体质量变化,体积不变,若容器内气体密度恒定时,标志反应达到平衡状态,故a正确;b、反应前后气体体积相同,所以增加反应物的物质的量,等同于加压,平衡不移动,平衡转化率相同,故错误;c、甲容器中平衡一氧化碳物质的量为0.4mol;乙容器中结合平衡常数计算得到消耗一氧化碳为1.4mol,平衡物质的量为0.6mol,甲和乙容器中CO的平衡浓度之比为0.4+0.6=2:3,故正确;d、固体量增加不影响化学平衡,增加Fe2O3不能提高CO的转化率,故错误。故选 ac。(4)①a、铁做阳极,失去电子,故没有被保护;b、铁做阴极,被保护;c、铁做正极,被保护;故选bc。②保护铁,则让铁做原电池的正极,X活动性比铁强,可以为锌。


科目:高中化学 来源: 题型:
【题目】400mL某溶液中含有0.1mol Fe2+、0.2mol Fe3+加入0.2mol铁粉,待Fe3+反应完全后,溶液中Fe2+的物质的量浓度为(假设反应前后溶液体积不变)( )
A.0.4mol·L-1 B.0.6mol·L-1 C.0.8mol·L-1 D.1.0mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用下图装置制备家用消毒液,并探究其性质。
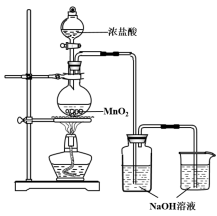
反应停止后,取洗气瓶中无色溶液5mL分别进行了如下实验:
操作 | 现象 |
a. 测溶液pH, 并向其中滴加2滴酚酞 | pH = 13, 溶液变红,5min后褪色 |
b. 向其中逐滴加入盐酸 | 溶液逐渐变成黄绿色 |
(1)写出利用上述装置制备消毒液涉及反应的化学方程式 、 。
(2)查阅资料:酚酞的变色范围为8.2~10,且酚酞在强碱性溶液中红色会褪去
为探究操作a中溶液褪色的原因,又补充了如下实验:
操作 | 现象 |
取 NaOH溶液,向其中滴加2滴酚酞 | 溶液变红,30min后褪色 |
获得结论:此实验小组制备的消毒液具有 性。
(3) 该小组由操作b获得结论:随着溶液酸性的增强,此消毒液的稳定性下降。
① 操作b中溶液变成黄绿色的原因: (用离子方程式表示)。
② 有同学认为由操作b获得上述结论并不严谨,需要进一步确认此结论的实验方案是 。
(4) 有效氯的含量是检测含氯消毒剂消毒效果的重要指标。具体用“单位质量的含氯消毒液在酸性条件下所能释放出氯气的质量”进行表征,一般家用消毒液有效氯含量在5%以上。小组同学进行如下实验测定有效氯:取此消毒液5 g,加入20 mL 0.5 mol·L-1 KI溶液,10 mL 2 mol·L-1的硫酸溶液;加几滴淀粉溶液后,用0.1 mol·L-1 Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O3 20 mL。(已知:2S2O32- + I2 === S4O62- + 2I-) 。注:相对原子质量Cl35.5,Na23,S32,O 16 ,I 127, K39
①达到滴定终点时的实验现象是 。
②此消毒液有效氯含量为 %(保留一位有效数字)。获得结论:此实验制得的消毒液 (填“符合”或“不符合”)家用要求。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法中,错误的是
A. 乙烯在常温常压下是气体,能使溴的四氯化碳溶液褪色
B. 苯可做有机溶剂,能使酸性高锰酸钾溶液褪色
C. 乙醇和乙烷都能发生取代反应
D. 乙酸乙酯在酸性条件下可以水解生成乙酸和乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如下图。下列有关氢氧燃料电池的说法正确的是
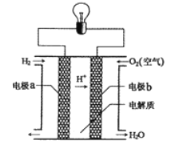
A.该电池工作时电能转化为化学能
B.该电池中电极a是正极
C.外电路中电子由电极b通过导线流向电极a
D.该电池的总反应:2H2+O2=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的数值。下列说法不正确的是
A.0.05 mol液态KHSO4中含有0.05 NA个阳离子
B.氢氧燃料电池正极消耗22.4 L气体时,电路中通过电子的数目为4 NA
C.常温下,100 mL 1 molL-l盐酸与4.6 g钠反应生成H2分子数目为0.1NA
D.在电解精炼粗铜的过程中,当阴极析出32 g铜时转移电子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.乙烯是石油裂解气的主要成分,下图是石蜡油在炽热碎瓷片的作用下裂解,下列装置检验其性质,完成下列问题。

(1)A中碎瓷片的作用是_____________。
(2)B中反应类型是_____________,C中实验现象是__________________。
II.用如图所示的装置进行实验,回答下列问题:
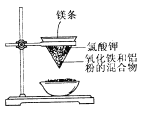
(1)写出该反应的化学方程式:_____________________。
(2)选出该实验的实验现象(把序号填写在横线上):________________。
①镁条剧烈燃烧;②放出大量的热,并发出耀眼的光芒;③纸漏斗的下部被烧穿;④有红热状态的液珠落入蒸发皿内的细沙上,液珠冷却后变为黑色固体。
(3)写出下列操作或物质的作用:镁条________;氯酸钾_________;蒸发皿盛沙____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲酸钾是一种白色晶体,商品名为弗米(Formil),是一种能替代抗生素的促生长剂,化学式为KH(HCOO)2,具有吸湿性,易溶于水。
二甲酸钾的生产工艺流程如下:
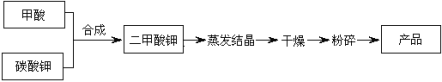
(1)写出甲酸和碳酸钾生产二甲酸钾的化学方程式: 。
(2)测定某弗米产品纯度的实验方法如下:
称取该弗米产品2.5g,将其全部溶解在水中,配制成250mL未知浓度的溶液,取出25.00mL于锥形瓶中,再滴加2~3滴指示剂,用0.10mol·L-1的NaOH溶液滴定至终点,消耗NaOH溶液的体积为18.50mL。
①加入的指示剂是 (选填“甲基橙”、“石蕊”或“酚酞”),用NaOH溶液滴定至终点的现象是 。
②上述弗米产品中二甲酸钾的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“C化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、CH3OH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义。
(1)一定温度下,在两个容积均为2 L的密闭容器中,分别发生反应:CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g) ΔH=-49.0 kJ/mol。相关数据如下:
CH3OH(g) + H2O(g) ΔH=-49.0 kJ/mol。相关数据如下:
容器 | 甲 | 乙 |
反应物投入量 | 1 mol CO2(g)和3 mol H2(g) | 1 mol CH3OH(g)和1 mol H2O(g) |
平衡时c(CH3OH) | c1 | c2 |
平衡时能量变化 | 放出29.4 kJ | 吸收a kJ |
请回答:①c1 c2(填“>”、“<”或“=”);a= 。
②若甲中反应达到平衡耗时10 s,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是_____mol/(L·s)。
(2)向体积为1 L的密闭容器中充入b mol CO和2b mol H2,发生反应CO(g)+2H2(g)![]() CH3OH(g)。平衡时CO的转化率与温度的关系如图所示。请回答下列问题:
CH3OH(g)。平衡时CO的转化率与温度的关系如图所示。请回答下列问题:

①正反应属于 (填“吸”或“放”)热反应。
②100℃时,该反应的平衡常数K= (用含b的代数式表示)。
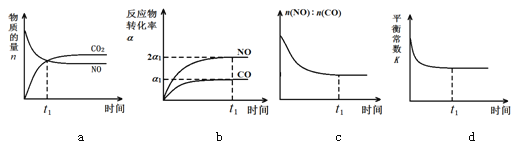
(3)治理汽车尾气的反应是2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH<0。在恒温恒容的密闭容器中通入n(NO):n(CO)=1:2的混合气体,发生上述反应。下列图像正确且能说明反应在进行到t1时刻一定达到平衡状态的是 (选填字母)
2CO2(g)+N2(g) ΔH<0。在恒温恒容的密闭容器中通入n(NO):n(CO)=1:2的混合气体,发生上述反应。下列图像正确且能说明反应在进行到t1时刻一定达到平衡状态的是 (选填字母)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com