
【题目】火力发电厂释放出大量氮的氧化物(NOx)、二氧化硫等气体会造成环境污染,对燃煤废气进行脱除处理。可实现绿色环保、低碳减排、废物利用等目的。
(1)己知:N2 (g) +O2 (g) =2NO (g) △H=+180.5kJ·mol-1
C (s) +O2 (g)=CO2 (g) △H=-393.5 kJ·mol-1
2C (s) +O2(g) =2CO (g)△H=-221 kJ·mol-1
若某反应的平衡常数表达式为:  ,请写出此反应的热化学方程式_________。
,请写出此反应的热化学方程式_________。
(2)脱硝
利用甲烷与NO2反应,生成无污染的物质,则该反应的化学方程式为:___________。
(3)脱碳
将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H3
CH3OH(g)+H2O(g)△H3
①取五份等体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线(见如图1),则上述CO2转化为甲醇反应的△H3_____0(填“>”、“<”或“=”)。
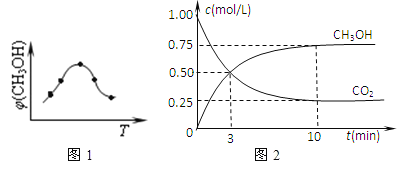
②在一恒温恒容密闭容器中充入0.5molCO2和1.5molH2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如上图2所示.请回答:第10min后,若升温,该反应的平衡常数将_____(填“变大”、“变小”、“不变”);若向该容器中再充入1molCO2和3molH2再次达到平衡时,则CH3OH(g)的体积分数将___(“变大”、“变小”、“不变”)。
(4)脱硫
某种脱硫工艺中将废气经处理后,与一定量的氨气、潮湿的空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥.设烟气中的SO2、NO2的物质的量之比为1:1,则该反应的化学方程式为__________。若在0.1mol/L的硝酸铵溶液中加入等体积的0.09mol/L氨水,配制了pH=8.2的溶液,则该溶液中微粒浓度由大到小的顺序为______________。
【答案】 2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5kJ/mol CH4 + 2NO2 = N2 + CO2 + 2H2O < 变小 变大 12NH3+3O2+4SO2+4NO2+6H2O=4(NH4)2SO4+4NH4NO3 c(NH4+)> c(NO3﹣)> c(NH3H2O)> c(OH﹣)>c(H+)
【解析】(1)因为反应的平衡常数为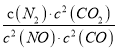 ,所以反应方程式为2NO(g)+2CO(g)=N2(g)+2CO2(g)。将第二个方程式扩大2倍,减去第一个方程式,再减去第三个方程式皆可以得到上面的反应,该反应的△H=2×(-393.5)-180.5-(-221)=-756.5 kJ/mol,所以热化学方程式为:2NO(g)+2CO(g)=N2(g)+2CO2(g)△ H=-746.5kJ/mol。
,所以反应方程式为2NO(g)+2CO(g)=N2(g)+2CO2(g)。将第二个方程式扩大2倍,减去第一个方程式,再减去第三个方程式皆可以得到上面的反应,该反应的△H=2×(-393.5)-180.5-(-221)=-756.5 kJ/mol,所以热化学方程式为:2NO(g)+2CO(g)=N2(g)+2CO2(g)△ H=-746.5kJ/mol。
(2)甲烷与NO2反应,生成无污染的物质,一定是得到CO2、N2和H2O,根据化合价升降相等和原子个数守恒得到方程式为:CH4 + 2NO2 = N2 + CO2 + 2H2O。
(3)①该图像是发生上述反应,反应相同时间后,再测体系中甲醇的体积分数,即不一定是平衡状态的体积分数。当温度比较低的时候,反应速率比较慢,则这个时间点上还没有达平衡,那么反应的速率越快,反应的量越多,甲醇的体积分数越大;当温度较高的时候,反应速率比较快,则这个时间点上应该已经达到平衡态,那么随着温度变化对平衡产生影响,甲醇的体积分数也会变化。根据以上理论,图像中右半边温度较高的区域是平衡移动导致甲醇的体积变化,温度升高肌醇体积分数降低,说明升温平衡逆向移动,正反应放热,即△H3<0。
②该反应放热,升高温度平衡常数减小。恒容,原来加入0.5molCO2和1.5molH2,再充入1molCO2和3molH2,就是同时同比例增大所有反应物的浓度,甲醇体积分数的变化相当于不加入物质,直接增大压强,增大压强平衡向正反应方向移动,甲醇的体积分数增大。
(4)根据题目表述反应物为氨气、二氧化硫、一氧化氮、水,生成物一定有硫酸铵和硝酸铵,所以得到部分反应方程式:NH3+O2+SO2+NO2+H2O→(NH4)2SO4+NH4NO3,因为烟气中的SO2、NO2的物质的量之比为1:1,所以将两者视为一个整体,化合价升高3价(S升高2价,N升高1价),O2降低4价,所以O2的系数为3,SO2、NO2的系数都是4。最后根据原子个数守恒配平即得:12NH3+3O2+4SO2+4NO2+6H2O=4(NH4)2SO4+4NH4NO3。若在0.1mol/L的硝酸铵溶液中加入等体积的0.09mol/L氨水,则溶液中硝酸铵的浓度为0.05mol/L,一水合氨的浓度为0.045mol/L,即开始时可以认为:c(NH4+)= c(NO3﹣)=0.05mol/L, c(NH3H2O)=0.045mol/L。溶液的pH=8.2,说明一水合氨的电离占主导地位。一水合氨电离为铵根离子,所以c(NH4+)> c(NO3﹣)> c(NH3H2O),明显溶液中一水合氨的电离程度较小,氢氧根的浓度应该远小于一水合氨的浓度,溶液显碱性有:c(OH﹣)>c(H+),所以有:c(NH4+)> c(NO3﹣)> c(NH3H2O)> c(OH﹣)>c(H+)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一种从含Br-废水中提取Br2的过程,包括过滤、氧化、正十二烷萃取及蒸馏等步骤。己知:
Br2 | CCl4 | 正十二烷 | |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |
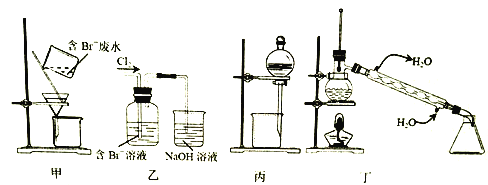
下列说法正确的是
A. 用甲装置过滤时,需不断搅拌
B. 丙装置中用正十二烷而不用CCl4,是因为其密度小
C. 用乙装置将Br-氧化为Br2
D. 可用装置丁进行蒸馏,先收集正十二烷再收集Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A. 水的电离程度始终增大
B. ![]() 先增大再减小
先增大再减小
C. c(CH3COOH)与c(CH3COO-)之和始终保持不变
D. 当加入氨水的体积为10 mL时,c (NH4+)=c(CH3COO-)
【答案】D
【解析】试题分析:A、CH3COOH属于弱酸,抑制水的电离,加入NH3·H2O,消耗CH3COOH,水的电离程度增大,但氨水过量后,对水电离抑制,故错误;B、当向CH3COOH溶液中滴加相同浓度的NH3·H2O,开始时溶液为CH3COOH和CH3COONH4的混合物,由CH3COONH4的水解常数Kh=[c(H+)×c(NH3·H2O)]/c(NH4+),随着氨水的加入,c(H+)逐渐减小,Kh不变,因此c(NH4+)/c(NH3·H2O)变小,当氨水至溶液显碱性时,氨水的电离常数Kb=[c(OH-)×c(NH4+)]/c(NH3·H2O),随着氨水的加入,c(OH-)逐渐增大,Kb不变,c(NH4+)/c(NH3·H2O)变小,因此此比值始终变小;C、根据物料守恒,n(CH3COOH)+n(CH3COO-)=0.001mol,由于溶液体积逐渐增大,因此c(CH3COOH)和c(CH3COO-)之和逐渐减小,故错误;D、当加入氨水的体积为10mL,醋酸和NH3·H2O物质的量相等,由于二者电离常数相等,因此溶液显中性,c(H+)=c(OH-),根据电荷守恒,c(NH4+)=c(CH3COO-),故正确。
考点:考查电离平衡常数、水解平衡常数、离子浓度大小比较等知识。
【题型】单选题
【结束】
13
【题目】常温下,下列有关离子浓度及pH大小的比较,正确的是( )
A. NH4+浓度相同的下列溶液:①(NH4)2Fe(SO4)2 ②(NH4)2CO3 ③(NH4)2SO4,溶液浓度由大到小的顺序是:③>②>①
B. 由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,其离子浓度不可能是:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C. pH=13的Ba(OH)2溶液与pH=1的HCl溶液等体积混合后,混合溶液的pH>7
D. pH=12的Ba(OH)2溶液与pH=14的NaOH溶液等体积混合,混合溶液的pH范围是13<pH<14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】40℃时,在氨—水体系中不断通入CO2,各种离子的变化趋势如下图所示。下列说法不正确的是( )
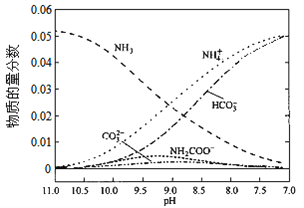
A. 在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COO-)>c(CO32-)
B. 不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-)
C. 在溶液中pH不断降低的过程中,有含NH2COOˉ的中间产物生成
D. 随着CO2的通入,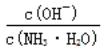 不断增大
不断增大
【答案】D
【解析】从图中在pH=9的点,做一条垂线就可以大致判断其浓度,所以有c(NH4+)>c(HCO3-)>c(NH2COO-)>c(CO32-),选项A正确。c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-)是溶液的电荷守恒,所以是任何pH下都成立的。选项B正确。随着pH的降低,NH2COOˉ的浓度增大,说明生成了含有NH2COOˉ的化合物,后期NH2COOˉ的浓度又减小,说明该化合物又被反应,说明含有NH2COOˉ的化合物是中间产物,选项C正确。根据一水合氨的电离平衡常数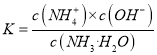 ,得到
,得到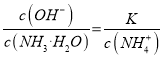 ,因为通入二氧化碳实际就是加入碳酸,加入酸c(NH4+)一定增大,所以
,因为通入二氧化碳实际就是加入碳酸,加入酸c(NH4+)一定增大,所以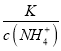 减小,即
减小,即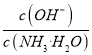 减小,选项D错误。
减小,选项D错误。
【题型】单选题
【结束】
17
【题目】下列物质中:A.KI(s) B.C2H5OH(l) C.Cl2(g) D.CH3COOH(l)E.BaSO4(s) F.NaHSO4(aq) G.石墨(s) H.蔗糖(s) I.NaOH(l) J.硫酸 K.盐酸
(1)属于非电解质的是____________(填序号,下同),属于强电解质的是____________,属于弱电解质的是____________。
(2)能直接导电的是________________,电解质中能溶于水,且水溶液能导电是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)将一定质量的镁铝合金投入100 mL一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为5 mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图。(横坐标体积单位是mL,纵坐标质量单位是g)求:
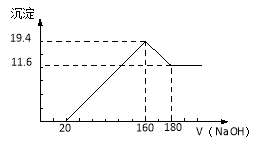
(1)合金中Mg的质量.
(2)所用HCl的物质的量浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A. 铜溶于0.5mo/L的硝酸:Cu+4H++2NO3- =Cu2++2NO2↑+2H2O
B. Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+=SO42-+3S↓+2H2O
C. 向Ba(OH)2溶液中加入少量的NH4HSO4溶液:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D. Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于卤代烃的说法正确的是
A.在溴乙烷(CH3CH2Br)分子中,溴元素的存在形式为溴离子
B.在卤代烃中,卤素原子与碳原子形成共价键
C.聚四氟乙烯(塑料王)为高分子化合物,不属于卤代烃
D.卤代烃比相应的烷烃的沸点低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com