
【题目】如图是元素M的价类二维图。其中A是一种盐,E的相对分子质量比D的相对分子质量大16,A和B是含最低价M元素的两种化合物,当x为一种强碱时,有如下转化关系。下列说法不正确的是( )

A.物质B遇少量的氯气会产生白烟
B.F的浓溶液可以用铁制容器盛放
C.E与水反应可生成F
D.物质D能够被x完全吸收
【答案】D
【解析】
A是一种盐,E的相对分子质量比D的相对分子质量大16,两者皆为氧化物,可初步判断E比D多一个氧原子。联想已构建的中学化学知识网络,符合这种转化关系的有:SO2→SO3,NO→NO2等。由此可出推断y为O2,由于F为酸,则E应为能转化为酸的某物质,很可能为SO3、NO2等。若E为NO2,顺推F为HNO3,Z为H2O,逆推D为NO,C为N2, B为NH3,A为铵盐。而X是强碱,A能与强碱生成B,综合而得A应为铵盐,B为NH3,C为N2,D为NO,E为NO2,F为HNO3,Z为H2O。
A.物质B为NH3,遇少量的氯气会生成NH4Cl,即产生白烟,A正确;
B.F的浓溶液为浓HNO3,铁与浓硝酸会发生钝化反应,所以浓硝酸可以用铁制容器盛放,B正确;
C.E为NO2,与水反应可生成F(HNO3),C正确;
D.物质D为NO,x为强碱,NO与x不反应,D错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 |
|
| HClO |
|
|
电离平衡常数 |
|
|
|
|
|
(1)25℃时,等浓度的![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液,3种溶液的pH由大到小的顺序为________。
溶液,3种溶液的pH由大到小的顺序为________。
(2)工业上可用氨水除去尾气![]() 。将
。将![]() 通入氨水中,当
通入氨水中,当![]() 降至
降至![]() _____。
_____。
(3)常温下,用![]() 溶液滴定
溶液滴定![]() 溶液所得滴定曲线如图:
溶液所得滴定曲线如图:
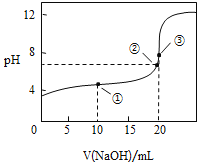
①在整个实验过程中,不需要的仪器或用品是 ______(填序号).
![]() 容量瓶 b 锥形瓶c 滴定管夹d 漏斗e 玻璃棒f 滴定管
容量瓶 b 锥形瓶c 滴定管夹d 漏斗e 玻璃棒f 滴定管
②到达滴定终点的标志是 _____________ .
③下列操作会导致测定结果偏高的是 ______ .
A 碱式滴定管在装液前未用标准NaOH溶液润洗
B 滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
C 碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D 达到滴定终点时,仰视读数
④如图点①所示溶液中![]() __________
__________![]() 填“>”“<”或“=”,下同,点②所示溶液中:
填“>”“<”或“=”,下同,点②所示溶液中:![]() ________
________![]() ,点③所示溶液中所有离子浓度由大到小的顺序为:_________。
,点③所示溶液中所有离子浓度由大到小的顺序为:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种从废旧锂电池中回收Li2SO4、CuSO4、CoSO4等有价金属的工艺流程如下:
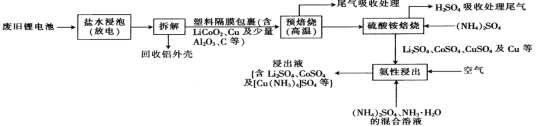
已知:“盐水浸泡”是将废旧锂电池置于食盐水中浸泡放电;“氨性浸出”时溶液呈弱碱性。
回答下列问题:
(1)“盐水浸泡”进行放电,放电的目的是________________________。
(2)“预焙烧”的目的是____________________,可用于吸收该过程产生的尾气的试剂是____________________。
(3)“硫酸铵焙烧”时,硫酸铵的作用是______________________________;“H2SO4吸收处理尾气”后的溶液可循环利用,则“硫酸铵焙烧”时的尾气中含___________(填化学式)。
(4)“氨性浸出”时,通入空气的目的是__________________________。
(5)“氨性浸出”时,Cu单质被浸出为[Cu(NH3)4]SO4,该反应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国产航母山东舰已经列装服役,它是采用模块制造然后焊接组装而成的,对焊接有着极高的要求。实验室模拟在海水环境和河水环境下对焊接金属材料使用的影响(如图)。下列相关描述中正确的是
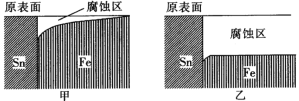
A.由图示的金属腐蚀情况说明了Sn元素的金属性强于Fe元素
B.由图示可以看出甲是海水环境下的腐蚀情况,乙是河水环境下的腐蚀情况
C.两种环境下铁被腐蚀时的电极反应式均为Fe-3e-=Fe3+
D.为了防止舰艇在海水中被腐蚀,可在焊点附近用锌块打“补丁”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如果发现了原子序数为114的元素,下列对它的叙述中正确的是( )
①位于第七周期②非金属元素③最外电子层有4个电子④没有放射性⑤属于第IVA族元素⑥属于锕系元素.
A.①③⑤B.②⑥C.①③⑥D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表为元素周期表短周期的一部分,下列有关A、B、C、D四种元素的叙述正确的是( )
A | B | C | ||
D | ||||
A.原子半径大小比较为D>C>B>A
B.生成的氢化物分子间均可形成氢键
C.A与C形成的阴离子可能有AC![]() 、A2C
、A2C![]()
D.A、B、C、D的单质常温下均不导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是周期表中短周期的一部分,A、B、C三种元素原子核外的电子数之和等于B原子的质量数。B原子核内的质子数和中子数相等。下列叙述不正确的是( )

A.A C B三种元素分别为氮、氟、硫
B.A元素最高价氧化物对应的水化物具有强氧化性
C.B元素的氧化物、氢化物的水溶液都呈强酸性
D.C元素是非金属性最强的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)镍元素基态原子的价电子排布式为________;3d能级上的未成对的电子数为________。
(2)硫酸镍溶于氨水形成![]() 蓝色溶液,
蓝色溶液,![]() 中配体的空间构型是________,阴离子的空间立体构型是________。
中配体的空间构型是________,阴离子的空间立体构型是________。
(3)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO________FeO(填“![]() ”或“
”或“![]() ”)。
”)。
(4)元素铜与镍的第二电离能分别为:I(Cu)=1959kJ/mol,I(Ni)=1753kJ/mol,I(Cu)> I(Ni)的原因是________。
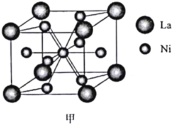
(5)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图甲所示。该合金的化学式为________。
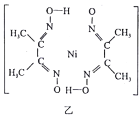
(6)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如图乙所示。该结构中,除共价键外还存在配位键和氢键。请在图中用“→”和“…”表示出配位键和氢键。(提示:Ni2+的配位数为4)________。
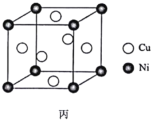
(7)某镍白铜合金的立方晶胞结构如图丙所示。若合金的密度为dg·cm-3,晶胞参数a=________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温条件下,下列对醋酸的叙述中,不正确的是
A.pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-)
B.将pH=a的醋酸稀释为pH=a+1的过程中,c(CH3COOH)/c(H+)变小
C.浓度均为0.1 mol·L-1的CH3COOH和CH3COONa溶液等体积混合后:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)]
D.等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和时,存在a+b=14
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com