
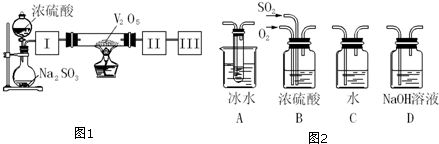
分析 (1)实验室利用浓硫酸和亚硫酸钠反应生成硫酸钠、二氧化硫和水,据此可写出反应方程式;
(2)可以用浓硫酸来干燥二氧化硫气体;SO3的熔点是16,8℃,较低,可以用冰水来获得三氧化硫,Ⅲ中为吸水和尾气处理;
(3)气体的制备及性质实验中需要检查装置的气密性;
(4)根据(1)中的热化学方程式,升温平衡向逆反应方向进行判断;
(5)为使残留在装置中的SO2、SO3被充分吸收,用氧气把装置中的二氧化硫和三氧化硫赶到A装置中吸收三氧化硫,二氧化硫赶入D装置中被氢氧化钠溶液吸收;
(6)依据硫元素守恒计算得到反应生成的三氧化硫物质的量,和剩余二氧化硫被氢氧化钠吸收的物质的量,根据转化率概念计算得到.
解答 解:(1)利用浓硫酸和亚硫酸钠固体反应制备二氧化硫反应方程式为Na2SO3+H2SO4═Na2SO4+H2O+SO2↑,故答案为:Na2SO3+H2SO4═Na2SO4+H2O+SO2↑;
(2)Ⅰ装置必须要对二氧化硫进行干燥,可以用浓硫酸来干燥二氧化硫气体;SO3的熔点是16,8℃,可以用冰水来获得三氧化硫;未反应掉的二氧化硫对空气会产生污染,Ⅲ中应该加氢氧化钠溶液尾气处理装置,故答案为:B;A;D;
(3)实验前,必须进行的操作是检查装置的气密性,故答案为:检查装置的气密性;
(4)根据(1)中的热化学方程式,升温平衡向逆反应方向进行,所以SO2的转化率会减小,故答案为:减小;
(5)为使残留在装置中的SO2、SO3被充分吸收,用氧气把装置中的二氧化硫和三氧化硫赶到A装置中吸收三氧化硫,二氧化硫赶入D装置中被氢氧化钠溶液吸收,
故答案为:继续通入氧气一段时间;
(6)已知Ⅱ增加的质量为b g即三氧化硫的质量,因此,反应生成三氧化硫的二氧化硫物质的量=$\frac{bg}{80g/mol}$;装置Ⅲ增加的质量为a g即被氢氧化钠吸收的剩余二氧化硫物质的质量,因此,剩余的二氧化硫物质的量=$\frac{ag}{64g/mol}$;所以二氧化硫的转化率=$\frac{\frac{b}{80}}{\frac{b}{80}+\frac{a}{60}}$×100%=$\frac{4b}{4b+5a}$×100%,故答案为:$\frac{4b}{4b+5a}$×100%.
点评 本题考查二氧化硫的性质、化学平衡的影响因素、计算以及化学方程式的书写等知识,综合性较强,题目难度较大,考查学生分析和解决问题的能力,侧重实验及计算能力的考查.


科目:高中化学 来源: 题型:解答题
 实验室可用浓硫酸和亚硫酸钠固体制备SO2,并验证其相关性质.装置如图所示
实验室可用浓硫酸和亚硫酸钠固体制备SO2,并验证其相关性质.装置如图所示查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性:KMnO4<Cl2 | |
| B. | 500mL12.8mol/L的盐酸与足量的KMnO4反应,可生成1.6 molCl2 | |
| C. | 此反应中氧化剂与还原剂的物质的量之比为1:8 | |
| D. | 实验室使用硫酸而不用盐酸酸化高锰酸钾,因为盐酸会被高锰酸钾氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
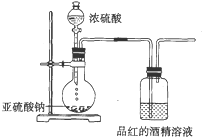 已知氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用.为了探究SO2的漂白作用到底是SO2本身具有的还是SO2与水作用的产物具有的,某学习小组设计了如图所示的装置来进行实验.请回答相关问题.
已知氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用.为了探究SO2的漂白作用到底是SO2本身具有的还是SO2与水作用的产物具有的,某学习小组设计了如图所示的装置来进行实验.请回答相关问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔质量:g?mol-1 | B. | 气体摩尔体积:L | ||
| C. | 物质的量:mol | D. | 物质的量浓度:mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
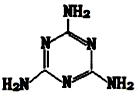 有机物三聚氰胺的结构如图所示:
有机物三聚氰胺的结构如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 维生素A属于烃 | |
| B. | 维生素A能发生取代、加成、酯化反应 | |
| C. | 维生素A不能使酸性KMnO4溶液褪色 | |
| D. | 维生素A不能与金属钠反应产生氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KSCN | B. | BaCl2 | C. | NaOH | D. | HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com