
 煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分.
煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分.| 温度/℃ | 250 | 300 | 350 |
| K/L2•mol-2 | 2.041 | 0.270 | 0.012 |
分析 (1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量,根据燃烧热的概念分别写出CO、甲醇燃烧的热化学方程式,然后利用盖斯定律写出甲醇不完全燃烧生成CO和液态水的热化学方程式;
(2)①升高温度,可逆反应向吸热反应方向移动,根据平衡常数与温度变化关系确定焓变;
②根据平衡浓度计算出平衡常数来确定温度;根据v=$\frac{△c}{△t}$计算反应速率;
(3)若在t1时刻将容器的体积缩小一倍,相当于增大压强,各组分的浓度立即增加原来的一倍,然后是平衡开始正向移动.
解答 解:(1)CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
氢气燃烧的热化学方程式为:①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1,
甲醇燃烧的热化学方程式为:②CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1,
由盖斯定律可知,②-①可得甲醇不完全燃烧生成CO和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2 H2O(l),△H=-726.5kJ•mol-1-(-283.0kJ•mol-1)=-443.5kJ•mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1;
(2)①升高温度,平衡向吸热方向移动,根据表格知,温度越高,化学平衡常数越小,说明平衡向逆反应方向移动,所以正反应是放热反应,即△H<0,
故答案为:<;
②CO(g)+2H2(g)?CH3OH(g)单位为mol/L
反应开始 1mol/L 3mol/L 0
反应 0.8mol/L 1.6mol/L 0.8mol/L
平衡 0.2mol/L 1.4mol/L 0.8mol/L
平衡常数K=$\frac{0.8}{0.2×1.{4}^{2}}$=2.04,所以是250℃;反应速率v(H2)=$\frac{1.6mol/L}{4min}$=0.4 mol•L-1•min-1,
故答案为:250℃;0.4 mol•L-1•min-1;
(3)若在t1时刻将容器的体积缩小一倍,相当于增大压强,各组分的浓度立即增加原来的一倍,然后是平衡开始正向移动,至新平衡,图示如下:
假定在t2时刻后又达到新的平衡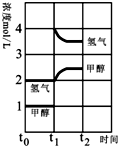 ;
;
故答案为: .
.
点评 本题考查了影响化学平衡移动的因素、速率的计算、热化学方程式盖斯定律应用等知识点,综合性强,难度大.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:选择题
| A. | 由于分子中氢原子数:H2SO4>HClO4,故酸性:H2SO4>HClO4 | |
| B. | 由子F元素的最低化合价为-1价,故F元素的最高化合价为+7价 | |
| C. | 硅处于金属与非金属的过渡位置,故硅可用作半导体材枓 | |
| D. | Cl-、S2-、Ca2+、K+半径逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 汽车排放的尾气为大气污染源之一,目前,可利用以下化学原理解决尾气:
汽车排放的尾气为大气污染源之一,目前,可利用以下化学原理解决尾气: .
.| 实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积 m2/g | 达平衡时所用的时间min |
| Ⅰ | 参照实验 | 280 | 6.50×10-3 | 4.00×10-3 | 80 | t |
| Ⅱ | 280 | 6.50×10-3 | 4.00×10-3 | 120 | 0.5t | |
| Ⅲ | 360 | 6.50×10-3 | 4.00×10-3 | 80 | 0.2t |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
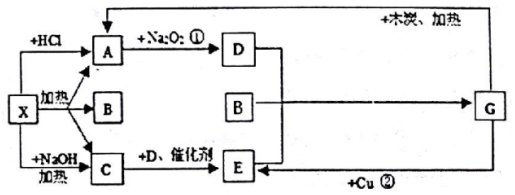
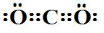 ;G的化学式为HNO3.
;G的化学式为HNO3.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 碳元素形成的单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔触的钾相互作用,形成某种青铜色的物质(其中的元素钾用“●”表示),原子分布如图所示,该物质的化学式为KC8.
碳元素形成的单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔触的钾相互作用,形成某种青铜色的物质(其中的元素钾用“●”表示),原子分布如图所示,该物质的化学式为KC8.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
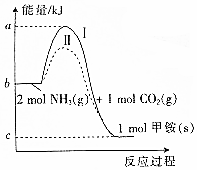 氨基甲酸铵(NH2COONH4,简称甲铵)是CO2和NH3制尿素的中间产物,其中CO2与NH3反应生成甲铵的能量变化如图所示.
氨基甲酸铵(NH2COONH4,简称甲铵)是CO2和NH3制尿素的中间产物,其中CO2与NH3反应生成甲铵的能量变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验编号 | 实验前温度/℃ | 实验后温度/℃ |
| ① | 24.8 | 33.8 |
| ② | 24.7 | 33.7 |
| ③ | 24.9 | 35.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属Na着火,立即用水扑灭 | |
| B. | 做蒸馏实验时,应使温度计水银球位于蒸馏烧瓶支管口处 | |
| C. | 衣服沾上大量浓氢氧化钠溶液,需将此衣服浸泡在盛水的盆中 | |
| D. | 测试某溶液的pH时,先用水润湿pH试纸,再将待测液滴到pH试纸上 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com