
| A. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| B. | 用惰性电极电解氯化钠溶液:4Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cl2↑+2H2↑+O2↑ | |
| C. | 用稀硝酸洗涤试管内壁的银镜:3Ag+4H++NO3-═3Ag++NO↑+2H2O | |
| D. | NaHCO3溶液中与滴加少量Ca(OH)2溶液:CO32-+Ca2+═CaCO3↓ |
分析 A.电荷不守恒;
B.不符合反应客观事实;
C.二者反应生成硝酸银、一氧化氮和水;
D.氢氧化钙少量,反应生成碳酸钙、碳酸钠和水;
解答 解:A.用FeCl3溶液腐蚀印刷电路板,离子方程式:2Fe3++Cu═2Fe2++Cu2+,故A错误;
B.用惰性电极电解氯化钠溶液生成氢氧化钠、氯气和氢气,离子方程式:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+2H2↑+2OH-,故B 错误;
C.用稀硝酸洗涤试管内壁的银镜,离子方程式:3Ag+4H++NO3-═3Ag++NO↑+2H2O,故C正确;
D.NaHCO3溶液中与滴加少量Ca(OH)2溶液,离子方程式:2HCO3-+2OH-+Ca2+═CaCO3↓+CO32-,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,题目难度不大.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:选择题
| A. | ①和② | B. | ② | C. | ③和④ | D. | 以上都不对 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
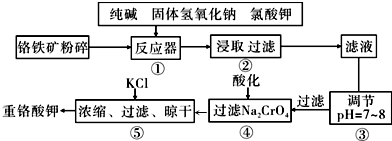
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
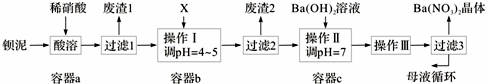
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入CH4的电极为正极 | |
| B. | 正极的电极反应式为O2+4H++4e-═2H2O | |
| C. | 通入CH4的一极的电极反应式为CH4+2O2+4e-═CO2+2H2O | |
| D. | 负极的电极反应式为CH4+10OH--8e-═CO32-+7H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 互称为同分异构体的物质不可能具有相同的通式 | |
| B. | 具有相同官能团的有机物不一定是同系物 | |
| C. | 糖类、油脂、蛋白质都是仅含C、H、O元素的有机物 | |
| D. | 燃烧产物是CO2、H2O的有机物一定烃类 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 海水成分 | Na+ | Ca2+ | Mg2+ | HCO3- | Zn2+ |
| 含量/mol•L-1 | 0.4 | 0.002 | 0.045 | 0.002 | 10-7 |
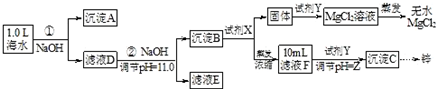
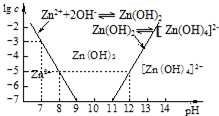
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 ;
; ,⑥所需的无机试剂及反应条件是氢氧化钠醇溶液、加热.
,⑥所需的无机试剂及反应条件是氢氧化钠醇溶液、加热.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com