
主族元素A、B、C、D的原子序数都小于18,A与D同主族,B与C在同一周期,A、D原子的最外层电子数都是1,C原子最外层电子数比B原子少2个,且C最外层电子数是次外层电子数的2倍。A、B单质在常温下均为气体,它们在高温下以体积比2∶1完全反应,生成物在常温下是液体。此液体与D单质能激烈反应生成A的单质。所得溶液滴入酚酞显红色,同时溶液中含有与氖原子的电子层结构相同的阳离子。
回答下列问题:
⑴写出元素符号A_ ___,B__ __,C__ __,D_ ___。
⑵写出B与C在高温下完全反应后生成物的化学式______ __,电子式___ __ ,结构式___ ___,分子具有____ _ 型空间结构。
⑶用电子式表示B、D在高温下形成的化合物的电子式_____ _ ___,判断其中的化学键的类型___ __ ___。
⑷写出一种有A、B、C、D组成的化合物的化学式___ ___。
科目:高中化学 来源: 题型:





查看答案和解析>>
科目:高中化学 来源: 题型:
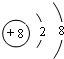
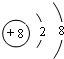






查看答案和解析>>
科目:高中化学 来源: 题型:


| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 | 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com