
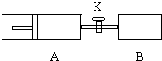
 (1)将一定量固体A置于一个容器体积不变的密闭容器中发生如下反应:
(1)将一定量固体A置于一个容器体积不变的密闭容器中发生如下反应:分析 (1)A﹑只要反应发生就符合v(B)=2v(C);
B﹑因为反应物为固体,所以容器中B、C的物质的量之比永远是2:1,所以密闭容器中的C(g)的体积分数始终不变;
C﹑密闭容器中混合气体的密度不变,说明气体的质量不变;
D﹑变密闭容器中总压强不变,说明气体的质量不变;
E﹑密闭容器中混合气体的平均分子量始终不变.
若该反应在升温过程中平衡气体的总浓度是增加的,平衡正向移动,说明正反应是吸热反应;
(2)打开K达新平衡等效为A中到达的平衡,根据X的转化率计算平衡后总的物质的量,再根据体积之比等于物质的量之比计算总体积,进而计算A容器的体积,升高温度,平衡向吸热方向移动,据此判断.
解答 解:(1)A﹑只要反应发生就符合v(B)=2v(C),不能作平衡状态的标志,故错误;
B﹑因为反应物为固体,所以容器中B、C的物质的量之比永远是2:1,所以密闭容器中的C(g)的体积分数始终不变,不能作平衡状态的标志,故错误;
C﹑密闭容器中混合气体的密度不变,说明气体的质量不变,达平衡状态,故正确;
D﹑变密闭容器中总压强不变,说明气体的质量不变,达平衡状态,故正确;
E﹑密闭容器中混合气体的平均分子量始终不变,不能作平衡状态的标志,故错误;
若该反应在升温过程中平衡气体的总浓度是增加的,平衡正向移动,说明正反应是吸热反应,所以△H>0,气体物质的量增加,熵变△S>O,
故答案为:CD;>;>;
(2)①A容器的平衡变化,建立新平衡后,(容积为0.5aL与容积为1.4aL相比)Y的体积分数要减小,即平衡时Y体积分数A<B,故答案为:大于;
②打开K达新平衡等效为A中到达的平衡,X的转化率为80%,参加反应的X的总的物质的量为3mol×80%=2.4mol,则:
X(g)+Y(g)?2Z(g)+W(g) 物质的量增多
1mol 1mol
2.4mol 2.4mol
故平衡后容器内总的物质的量为(1mol+1mol+2mol+2mol)+2.4mol=8.4mol,气体的体积之比等于气体的物质的量之比,则总容器的体积为aL×$\frac{8.4mol}{2mol}$=4.2aL,则A的体积=4.2aL-a=3.2a,故答案为:3.2a.
点评 本题难度较大,需要设计平衡和变换平衡,要求有清晰的思维过程,是一则训练思维的好题.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L甲醇中含有的氧原子数为1.0NA | |
| B. | 常温常压下,46gNO2与 N2O4的混合气体中含有的原子总数为3NA | |
| C. | 标准状况下,2.24LCl2与足量的稀NaOH溶液反应,转移电子总数为0.2NA | |
| D. | 1L 1 mol•L-1的盐酸中,所含氯化氢分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应中,N2是还原剂,Al2O3是氧化剂 | |
| B. | AlN的摩尔质量为41 g | |
| C. | AlN中氮元素的化合价为+3 | |
| D. | 上述反应中,每生成1 mol AlN需转移3 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

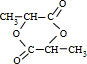 .
.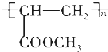 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 25 | T1 | T2 |
| 水的离子积常数 | 1×10-14 | a | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当混合气体的质量不再发生变化时,说明反应达到平衡状态 | |
| B. | 用M表示此反应速率是0.1 a mol•(L•min)-1 | |
| C. | 用X表示此反应的反应速率是(0.1-0.2 a)mol•(L•min)-1 | |
| D. | 其他条件不变向上述平衡体系中再充入lmolX,v(正)增大,v(逆)减小,平衡正向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com