

 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源:不详 题型:实验题
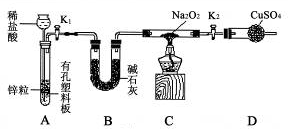
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
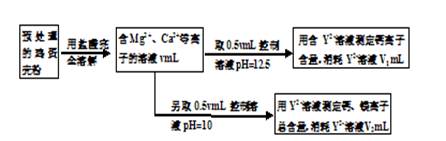

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.碱式滴定管用蒸馏水洗净后,直接加入未知浓度的NaOH溶液 |
| B.锥形瓶用蒸馏水洗净后,直接加入一定体积的未知浓度的NaOH溶液 |
| C.滴定前,没有逐出酸式滴定管尖嘴处的气泡,滴定终点时气泡消失 |
| D.滴定前读数正确,达到滴定终点后,俯视读数 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
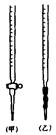
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
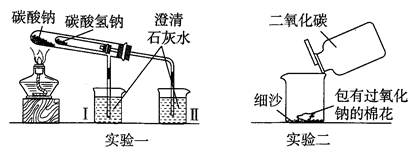
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.配制一定物质的量浓度的溶液,定容时俯视容量瓶的刻度线,会使所配溶液的浓度偏低 |
| B.向FeSO4溶液中滴入NaOH溶液,可立即观察到红褐色沉淀 |
| C.可用湿润的淀粉KI试纸检验HCl气体中是否含有Cl2 |
| D.SO2能使滴有酚酞的NaOH溶液褪色,说明SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将坩埚直接放在三角架上进行加热 |
| B.坩埚在加热前未完全干燥,可使测定的结果偏低 |
| C.加热温度过高,使一部分硫酸铜分解,可使测定结果偏高 |
| D.实验步骤的顺序为:称量、研磨、加热、冷却、称量、再加热、冷却、称量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②③⑤①⑥⑦④ | B.④⑥①③②⑤⑦ |
| C.④②⑤⑥①③⑦ | D.②⑥⑦④③⑤① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com