
| A. | 17g羟基和17gOH-含有的电子数均为10NA | |
| B. | 2L0.5 mol•L-1醋酸溶液中含有的H+数为NA | |
| C. | 标准状况下,NA个NO分子和0.5NA个O2分子充分反应后气体体积为22.4L | |
| D. | 7.8gNa2O2与足量的CO2和H2O(g)混合气体充分反应,转移的电子数为0.1NA |
分析 A.1个羟基含有9个电子,1个氢氧根离子含有10个电子;
B.醋酸为弱酸,部分电离;
C.二氧化氮气体中存在平衡:2NO2?N2O4;
D.过氧化钠和水、二氧化碳反应,过氧化钠都是既做氧化剂又做还原剂.
解答 解:A.17g羟基的物质的量为1mol,1mol羟基中含有9mol电子,含有的电子数为9NA,17gOH-含有的电子数均为10NA,故A错误;
B.2L0.5 mol•L-1醋酸溶液,醋酸部分电离,所以含有的H+数小于NA,故B错误;
C.NA个NO分子和0.5NA个O2分子混合后恰好完全反应生成1mol二氧化氮,但二氧化氮气体中存在平衡:2NO2?N2O4,导致分子个数减少,故气体分子个数小于NA个,故C错误;
D.过氧化钠和水、二氧化碳反应,过氧化钠都是既做氧化剂又做还原剂,1mol过氧化钠反应转移1mol电子,则7.8gNa2O2物质的量为$\frac{7.8g}{78g/mol}$=0.1mol,转移的电子数为0.1NA,故D正确;
故选:D.
点评 本题考查了阿伏伽德罗常数的分析应用,掌握公式的使用和物质的结构、状态是解题关键,注意过氧化钠与水、二氧化碳反应中表现的性质,题目难度中等.


科目:高中化学 来源: 题型:解答题
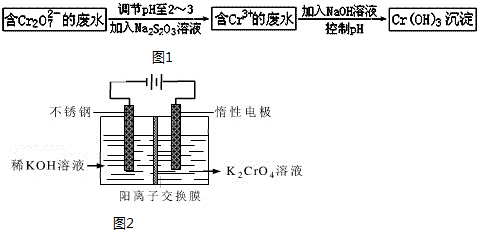
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 我国2015年玉月1日正式实施的《环境保护法》被称为“史上最严”环保法,为保护好环境,工业生产应从源头上减少或尽量消除生产对环境的污染 | |
| B. | 在某爆炸事故救援现场,消防员发现存放金属钠、电石、甲苯二异氰酸酯 等化学品的仓库起火,应立即用泡沫灭火器将火扑灭 | |
| C. | 世界卫生组织认为青蒿素(结构如右图所示)联合疗法是当下治疗疟疾最 有效的手段,已经拯救了上百万生命,靑蒿素属于烃类物质 | |
| D. | 某品牌化妆品在广告中反复强调:“十年专注自然护肤”,该产品中不含任何化学成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | SO2通入足量的稀Fe(NO3)3溶液 | 溶液由棕黄色变为浅绿色,但立即又变成棕黄色 | 氧化性:HNO3>稀硫酸>Fe3+ |
| B | 相同条件下,测定等浓度的Na2CO3和Na2SO3溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
| C | 将表面氧化的铜丝从酒精灯的外焰慢慢移向内焰 | 黑色的铜丝变红色 | 氧化铜被酒精灯内焰的乙醇蒸汽还原 |
| D | 取适量NH4Al(SO4)2样品置于试管中加水溶解,滴加少量稀NaOH溶液 | 湿润的红色石蕊试纸靠近试管口,试纸变蓝 | NH4Al(SO4)2溶液中存在NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作 | 实验现象 |
| 向2mL 0.1mol/LBaCl2 溶液(填化学式)中通入SO2 | 试管内有白色沉淀产生 |
| 实验操作 | 实验数据 |
| 向烧杯中加入煮沸了的0.1mol/L的BaCl2溶液25mL,再加入25mL植物油,冷却至室温,用pH传感器测定溶液pH随时间(t)的变化曲线 | 图1:向BaCl2(无氧)溶液中通入SO2 |
| 向烧杯中分别加入25mL 0.1mol/L的BaCl2溶液、Ba(NO3)2溶液,通入SO2,用pH传感器分别测定溶液pH随时间(t)变化的曲线. | 图2:分别向BaCl2、Ba(NO3)2溶液中通入SO2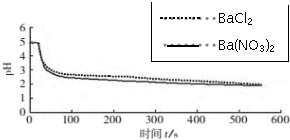 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| B. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| C. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 | |
| D. | 古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯、氯乙烯、丙烯分子中所有原子均在同一平面 | |
| B. | 汽油、柴油、植物油都是碳氢化合物 | |
| C. | 甲烷、乙烷、丙烷在光照下分别与氯气反应,生成的一氯代物都只有一种 | |
| D. | 乙醇、甲苯和溴苯可用水鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 丙 | ||
| 甲 | 乙 |
| A. | 单质熔沸点从高到低:甲>乙>丙 | B. | 气态氢化物的热稳定性:丙>甲>乙 | ||
| C. | 元素最高价态:丙>乙>甲 | D. | 原子半径从大到小:甲>乙>丙 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com