
【化学—物质结构与性质】M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s电子的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。请回答下列问题:
(1)R基态原子的电子排布式是 ,X和Y中电负性较大的是 (填元素符号)。
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是________________。
(3)X与M形成的XM3分子的空间构型是__________。
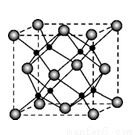
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如右图所示,则图中大球代表的离子是_________(填离子符号)。
(5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是_________。
(6)若晶胞的棱长为a cm ,则R2M晶体的密度为=___________g·cm–3。
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源:2017届江西省高三上学期第三次月考化学试卷(解析版) 题型:实验题
五种固体物质A、B、C、 D、E由下表中不同的阴阳离子组成,它们均易溶于水。
D、E由下表中不同的阴阳离子组成,它们均易溶于水。
阳离子 | Na+ | Al3+ | Fe3+ | Cu2+ | Ba2+ |
阴离子 | OH- | Cl- | CO32- | NO3- | SO42- |
分别取它们的水溶液进行实验,结果如下:
①A溶液与C溶液混合后产生蓝色沉淀,向该沉淀中加入足量稀HNO3,沉淀部分溶解,剩余白色固体;
②B溶液与E溶液混合后产生红褐色沉淀,同时产生大量气体;
③少量C溶液与D溶液混合后产生白色沉淀,过量C溶液与D溶液混合后无现象;
④B溶液与D溶液混合后无现象;
⑤将38.4 g Cu片投入装有足量D溶液的试管中,Cu片 不溶解,再滴加1.6 mol/L稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。
不溶解,再滴加1.6 mol/L稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。
(1)据此推断A的化学式为:A ;
(2)写出步骤②中发生反应的离子方程式 。
(3)D溶液中滴入石蕊试液,现象是 ,原因是 (用离子方程式说明)。
(4)步骤⑤中若要将Cu片完全溶解,至少加入稀H2SO4的体积是 mL。
查看答案和解析>>
科目:高中化学 来源:2017届贵州省高三上学期第二次月考化学试卷(解析版) 题型:推断题
分子式为C12H14O2的有机物F广泛用于制备香精的调香剂。为了合成该有机物,某实验室的科技人员设计了下列合成路线。
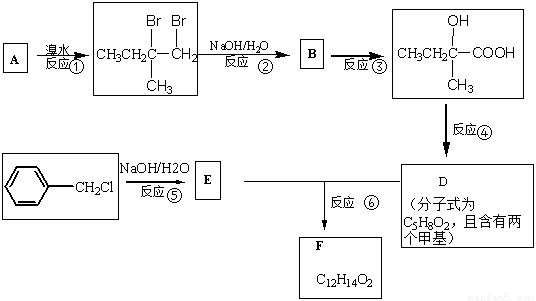
试回答下列问题:
(1)A物质与H2发生加成反应后,产物的名称为(系统命名) ;合成路线中反应③所属反应类型为 。
(2)反应④的化学方程为 。
(3)有机物D中总共有 种不同化学环境的氢原子,其核磁共振氢谱的峰面积比为 。
(4)反应⑥的化学反应方程式为 。
(5)E的同分异构体(含苯环)总共有 种,写出一种同时满足下列两个条件的同分异构体的结构简式 。要求:① 属于芳香族化合物。②不能与金属Na反应。
查看答案和解析>>
科目:高中化学 来源:2017届贵州省高三上学期第二次月考化学试卷(解析版) 题型:选择题
化学实验中,常将溶液或试剂进行酸化,下列酸化处理的措施中正确的是
A. 定性检验SO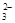 ,可用HNO3酸化的BaCl2溶液
,可用HNO3酸化的BaCl2溶液
B. 为了提高KMnO4溶液的氧化能力,可用盐酸将其酸化
C. 检验某溶液中是否含Cl–,用HNO3酸化的AgNO3溶液
D. 配制FeCl2溶液时通常加少量H2SO4酸化,减小其水解程度
查看答案和解析>>
科目:高中化学 来源:2017届贵州省高三上学期第二次月考化学试卷(解析版) 题型:选择题
能正确表示下列反应的离子方程式是
A.浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑
B.钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+
C.NaHCO3溶液与稀H2SO4反应:CO32-+2H+=H2O+CO2↑
D.氢氧化钠溶液吸收少量SO2气体:SO2+2OH-=SO32-+H2O
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上学期期中化学试卷(解析版) 题型:选择题
已知:SO32-+I2+H2O→SO42-+2I-+2H+。某溶液中可能含有Na+、NH4+、Fe2+、K+、I-、SO32-、SO42-,且所有离子物质的量浓度相等。向该无色溶液中滴加少量溴水,溶液仍呈无色。下列关于该溶液的判断正确的是
A.肯定不含I- B.肯定不含SO42-
C.肯定不含有SO32- D.肯定含有NH4+
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省绵阳市高一上第一次月考化学试卷(解析版) 题型:选择题
下列实验操作中,主要不是从安全因素考虑的是( )
A. 点燃氢气前一定要检验氢气的纯度
B. 未使用完的白磷要随时收集起来,并与空气隔绝
C. 酒精灯不用时,必须盖上灯帽
D. 用氢气还原氧化铜时,要先通一会儿氢气,再加热氧化铜
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
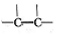 +ICl→
+ICl→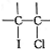 .ICl制备装置图如图,(夹持装置及加热仪器已省略);
.ICl制备装置图如图,(夹持装置及加热仪器已省略);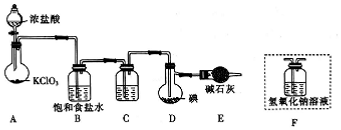
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com