
| A. | 将溶液稀释到原体积的10倍 | B. | 加入适量的醋酸钠固体 | ||
| C. | 加入等体积0.1 mol/L烧碱溶液 | D. | 加入等体积0.1 mol/L盐酸 |
分析 醋酸电离生成醋酸根离子和氢离子,要使溶液的pH增大,则溶液中氢离子浓度减小,据此分析解答.
解答 解:A、醋酸是弱电解质,加水稀释能促进水的电离,将溶液稀释到原体积的10倍,氢离子浓度大于原来的$\frac{1}{10}$,所以pH<(a+1),故A错误;
B、加入适量的醋酸钠固体,醋酸钠中含有醋酸根离子能抑制醋酸的电离,使溶液中氢离子浓度减小,所以能使溶液pH=(a+1),故B正确;
C、加入等体积0.1 mol/L烧碱溶液,能将醋酸恰好完全反应,得到的是0.05mol/L的醋酸钠溶液,溶液显碱性,故所得溶液的pH>7,故C错误;
D、加入等体积的0.1 mol•L-1盐酸,由于HCl是强电解质,故加入0.1mol/L盐酸后氢离子浓度增大,溶液的pH值减小,故D错误;
故选B.
点评 本题考查了弱电解质的电离,根据“加水稀释、提高温度都能促进醋酸的电离,加入含有相同离子的盐能抑制醋酸的电离”来分析解答,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
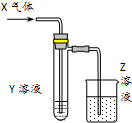 用以如图示装置研究物质的性质,能够获得可靠结论的是( )
用以如图示装置研究物质的性质,能够获得可靠结论的是( )| X | Y | Z | 结论 | |
| A | HCHO | 新制Cu(OH)2 | NaOH(aq) | 验证甲醛的还原性 |
| B | CH3Cl | AgNO3(aq) | NaOH(aq) | 验证一氯甲烷含氯元素 |
| C | SO2 | KMnO4(aq) | NaOH(aq) | 验证二氧化硫的漂白性 |
| D | Cl2 | 淀粉KI(aq) | NaOH(aq) | 验证氯气的强氧化性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
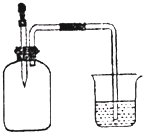
| A. | ①② | B. | ②③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
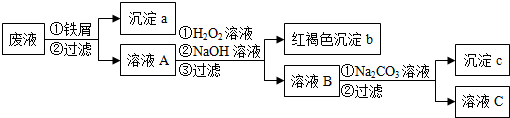
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Y | ||
| X | ||
| Z |
| A. | Y是非金属性最强的元素 | B. | Z是金属元素 | ||
| C. | Y的原子序数为a-7 | D. | X的气态氢化物化学式为H2X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 不同时间各物质的物质的量/mol | ||||
| 0min | 2min | 4min | 6min | |
| CH4 | 2.00 | 1.76 | 1.60 | n2 |
| H2 | 0.00 | 0.72 | n1 | 1.20 |
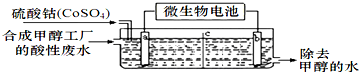
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | X是形成化合物类最多,它一气态氧化物能产生温室效应 |
| Y | Y是地壳中含量最多的元素 |
| Z | Z和Y形成一化合物Z2Y2为淡黄色粉末,可作为呼吸面具里氧气来源 |
| V | V的单质是淡黄色固体,是黑火药一主要成分 |
| W | 日常生活中应用最广泛的金属之一,且W有几种不同价态的氧化物,其中一种有磁性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com