
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | ||
| CO | H2O | H2 | CO | ||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 |
| 4mol-2.4mol |
| 4mol |
| 2mol-1.6mol |
| 2mol |
| 0.4×0.4 |
| 1.6×0.6 |


科目:高中化学 来源:不详 题型:单选题

 2NH3(g);ΔH<0,在673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如右图所示。下列叙述正确的是( )
2NH3(g);ΔH<0,在673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如右图所示。下列叙述正确的是( )
| A.点a的正反应速率比点b的大 |
| B.点c处反应达到平衡 |
| C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样 |
| D.其他条件不变,773 K下反应至t1时刻,n(H2)比上图中d点的值大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
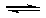 HX(g)的平衡常数为10。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于
HX(g)的平衡常数为10。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于
| A.5% | B.17% | C.25% | D.33% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.容器内压强不再变化 |
| B.单位时间内生成nmolA同时生成2nmolB |
| C.A、B、C浓度不再变化 |
| D.A、B、C的分子数之比为1:2:3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.容器内的压强不再变化 |
| B.混合气体的密度不再变化 |
| C.单位时间消耗amolA,同时消耗3amolC |
| D.混合气体的平均相对分子质量不再变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.B的生成速率与A的消耗速率相等 |
| B.体系的质量不再发生变化 |
| C.A、B、C的浓度之比为1:1:2 |
| D.每消耗1mol A同时生成2mol C |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②⑤ | B.③④⑥ | C.⑥⑦ | D.④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.C生成速率与C分解速率相等 |
| B.单位时间内生成amolA,同时生成3amolB |
| C.A、B、C的浓度不再变化 |
| D.单位时间内消耗amolA,同时生成3amolB |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
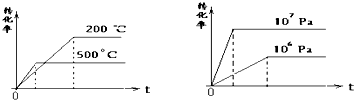
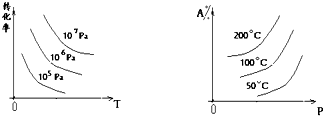
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com