
A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
(1) A中反应的离子方程式为 。
(2)B中Sn极的电极反应式为 。Sn极附近溶液的c (填 “变大”“变小”或“不变”)。
(填 “变大”“变小”或“不变”)。
(3)C中被腐蚀的金属是 ,总反应的化学方程式为
,比较A、B、C中铁被腐蚀的速率,由快到慢的顺序为 (填序号)。
(12分,每空2分)(1)Fe + 2H+= Fe + H2↑
(2)2H+ + 2e-=H2↑ 变小 (3)Zn,Zn + H2SO4= ZnSO4 + H2↑;B > A >C
解析试题分析:(1)装置A中铁直接与稀硫酸发生置换反应,反应的离子方程式是Fe + 2H+= Fe + H2↑。
(2)装置B中铁的金属性强于Sn的,则铁是负极,Sn是正极,溶液中的氢离子在正极得到电子,电极反应式是2H+ + 2e-=H2↑,所以正极周围溶液中氢离子浓度变小。
(3)装置C中锌的金属性强于铁的,锌失去电子,做负极,被腐蚀。铁是正极,被保护,总的方程式是Zn + H2SO4= ZnSO4 + H2↑。根据以上分析可知,A、B、C中铁被腐蚀的速率,由快到慢的顺序为B>A>C。
考点:考查原电池的有关应用、金属的腐蚀与防护
点评:该题是基础性试题的考查,也是高考中的重要考点。主要是考查学生对原电池原理以及金属腐蚀与防护的熟悉了解程度,意在培养学生分析、归纳和总结问题的能力。该题的关键是明确原电池的工作原理,然后结合题意灵活运用即可。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:填空题
如图所示,甲、乙两池的电极材料都是铁棒与碳棒,请回答下列问题:
(1)把化学能转化为电能的装置是 (填“甲”或“乙”)。
(2)①若两池中均盛有CuSO4溶液,反应一段时间后,有红色物质析出的是甲池中的 棒,乙池中的 棒。
②乙池中碳极上电极反应式是 。
(3)若两池中均盛有饱和NaCl溶液,
①写出乙池中总反应的化学方程式为 ,
②若将湿润的淀粉KI试纸放在乙池碳极附近,发现试纸变 ,发生此现象的离子方程式为 ;若往乙池中滴入酚酞试液, (填铁或碳)棒附近呈现红色。
③若乙池中通过0.02mol 电子后停止实验,反应后池中溶液体积是200mL,溶液混匀后的c(OH-)为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
高铁酸钾(K2FeO4)是铁的一种重要化合物,具有极强的氧化性。
(1)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-)=1.0×10-3mol·L-的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)随时间变化的结果如图1所示。
该实验的目的是_______________________;FeO42-发生反应的△H____________0(填“>”“<”或“=”)
(2)将适量K2FeO4分别溶解于pH=4.74、7.00、11.50的水溶液中,配制成c(FeO42-)=1.0×10-3 mol·L-的试样,静置,考察不同初始pH的水溶液对K2FeO4某种性质的影响,其变化图像见图2,800min时,在pH=11.50的溶液中,K2FeO4的浓度比在pH=4.74的溶液中高,主要原因是______________。
(3)电解法是工业上制备K2FeO4的一种方法。以铁为阳极电解氢氧化钠溶液,然后在阳极溶液中加入KOH,即在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明 。电解时阳极发生反应生成FeO42-,该电极反应式为______________。
(4)与MnO2—Zn电池类似,K2FeO4—Zn也可以组成高铁电池,K2FeO4在电池中作正极材料,其电极反应式为FeO42-+3eˉ+4H2O→Fe(OH)3+5OHˉ,则该电池总反应的离子方程式为_______________。图3为高铁酸钾电池和高能碱性电池放电曲线,由此可得出的高铁酸钾电池的优点有_______________________、________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
由软锰矿(主要成分为MnO2)制备KMnO4的实验流程可表示如下:
(1)操作Ⅱ的名称是____________。
(2)可循环利用的物质____________(填化学式)。
(3)反应②的产物中,氧化产物与还原产物的物质的量之比是______。
(4)反应②中“酸化”时不能选择下列酸中的______(填字母序号)
A.稀盐酸 B.稀硫酸 C.稀醋酸
(5)电解猛酸钾溶液也可以得到高锰酸钾,其阴极反应式为:2H2O+2e-=2OH-+H2↑,如下图,b作____________极,电解池的阳极反应式是____________;若电解过程中收集到2.24L H2(标准状况),则得到高锰酸 钾____________克。(提示:阴离子放电顺序MnO42->OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图所示表示的是电解饱和食盐水的装置,阴极材料、阳极材料都是碳棒,饱和食盐水中含有少量酚酞。
(1)接通电源后,饱和食盐水中的阳离子的移动方向是:向 极移动。
(2)电极上生成了气体A和B,生成气体A的电极反应式是 。
(3)随着气体的生成,饱和食盐水中产生了两种不同的颜色:一种是 色,其产生的位置是 (填“阴极区”或“阳极区”);另一种是 色,其产生的位置是 (填“阴极区”或“阳极区”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图为相互串联的甲乙两电解池
试回答:
(1)甲池若为用电解原理精炼铜的装置,则B是 极,材料是 ,A电极反应为 。
(2)乙池中若滴入少量石蕊试液,电解一段时间后Fe极附近呈 色.
(3)若甲池为电解精炼铜,阴极增重6.4g,则:乙池中阳极放出的气体在标准状况下的体积为 ;若此时乙池剩余液体为400 mL,则电解后得到碱液的物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(15分)海洋是一座巨大的宝藏,海水中蕴含80多种元素。氯碱工业和制备金属镁的原料都可来自于海水。
Ⅰ.在氯碱工业中,曾用石棉隔膜电解槽来电解食盐水(如图甲所示)。
(1)写出阳极的反应式 。
(2)图甲中流出的b是 溶液。
(3)石棉隔膜的作用是 。
Ⅱ.随着科技的发展,电解工艺不断革新,电解效率和产品纯度得到提高。20世纪80年代起,隔膜法电解工艺逐渐被离子交换膜电解技术取代。
(1)离子交换膜电解槽(如图乙所示)中⑥、⑦分别是_______、______________。
(2)已知一个电子的电量是1.602×10-19C,用离子膜电解槽电解饱和食盐水,当电路中通过1.929×105 C的电量时,生成NaOH_ g。
Ⅲ.下图是工业上生产镁的流程。
(1)写出下列反应的化学方程式:
①沉淀池: ; ②电解: ;
(2)整个生产流程中循环使用的物质是 。
(3)简述加热氯化镁的结晶水合物使之脱水转化为无水氯化镁的注意事项: 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
CuCl2溶液中的铜主要以Cu(H2O)42+、CuCl42-形式存在,它们间有如下转化关系:Cu(H2O)42+(蓝色)+4Cl- CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题:
CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题: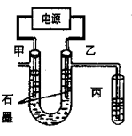
(1)甲电极的电极反应式为_________________。
(2)丙中溶液变蓝是乙电极产物与KI反应导致的,该反应的化学方程式为___。
(3)随电解的不断进行,U型管中溶液的颜色变化为__________;
A.由黄色变为浅蓝色 B.由蓝色变为浅黄色
溶液颜色变化的原因是_________________。
(4)当电解到一定程度,甲电极附近出现蓝色Cu(OH)2絮状物。经测甲电极附近溶液的pH=a,此时甲电极附近溶液中c(Cu2+)=______ mol·L-1。(已知:Cu(OH)2的Ksp=2.2×10-20)
(5)电解较长时间后,丙中溶液的蓝色又会褪去,这是因为乙电极产物进一步将I2氧化为IO3-,该反应的离子方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某工厂生产的某产品只含C、H、O三种元素,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等)。下列对该产品的描述不正确的是( ) 
A. 官能团为碳碳双键、羧基
B. 与CH2=CHCOOCH3互为同分异构体
C. 能发生氧化反应
D. 分子中所有原子可能在同一平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com