
A、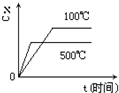 |
B、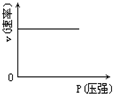 |
C、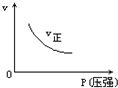 |
D、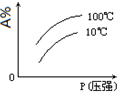 |


科目:高中化学 来源: 题型:
| A、物质的量是物质所含微粒的数量 |
| B、1摩尔氧气的质量等于NA个O2分子的相对分子质量之和 |
| C、阿伏伽德罗常数是人们规定的数,没有单位 |
| D、H2的相对分子质量、1molH2的质量与H2的摩尔质量三种单位不同,在数值上相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子式为C4H8O且可与金属钠反应放出氢气的有机化合物 |
| B、分子式为C5H10O2且与碳酸氢钠反应放出二氧化碳的有机化合物 |
| C、分子式为C5H10且能使溴的四氯化碳溶液褪色的有机化合物 |
| D、C6H14中沸点最高的烃与氯气反应后一氯代有机化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a<7时,水的电离受到抑制 |
| B、a>7时,水的电离受到抑制 |
| C、a<7时,溶液的pH一定为a |
| D、a>7时,溶液的pH一定为(14-a) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
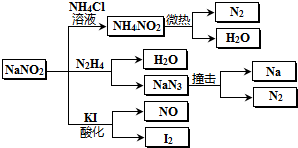
| A、NaNO2稳定性大于NH4NO2 |
| B、NaNO2与N2H4反应中,NaNO2是氧化剂 |
| C、可用KI-淀粉和食醋鉴别NaNO2和NaCl |
| D、分解NaN3盐每产生1molN2 转移6mol e- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com