
短周期元素X、Y、Z、W的原子序数依次增大,X 原子的最外层电子数是其内层电子总数的3 倍,Y 原子的最外层只有2 个电子,Z 单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是
A.元素W的简单气态氢化物的热稳定性比X 的强
B.元素W 的最高价氧化物对应水化物的酸性比Z 的弱
C.化合物YX、ZX2、WX3 中化学键的类型相同
D.原子半径的大小顺序: rY>rZ >rW >rX
科目:高中化学 来源:2014高考名师推荐化学实验专题(解析版) 题型:实验题
制备水杨酸对正辛基苯基酯( )如下:
)如下:
步骤一:将水杨酸晶体投入三颈烧瓶中,再加入氯苯,搅拌溶解后,加入无水三氯化铝。
步骤二:按图12所示装置装配好仪器,水浴加热控制温度在20~40℃之间,在搅拌下滴加SOCl2,反应制得水杨酰氯,该反应为:
 (水杨酸)+SOCl2→
(水杨酸)+SOCl2→ (水杨酰氯)+HCl↑+SO2↑
(水杨酰氯)+HCl↑+SO2↑

步骤三:将三颈烧瓶中的混合液升温至80℃,再加入对正辛苯酚( ),温度控制在100℃左右,不断搅拌。
),温度控制在100℃左右,不断搅拌。
步骤四:过滤、蒸馏、减压过滤;酒精洗涤、干燥。
(1)步骤一中加入三氯化铝的作用是 。
(2)实验时,冷凝管中的水应从 进 出(选填“a”或“b”);装置c的作用是 。
(3)步骤三??发生反应的化学方程式为 。
(4)步骤四减压过滤操作中,除烧杯、玻璃棒外,还必须使用的硅酸盐材料的仪器有 。
(5)步骤四减压过滤时,有时滤纸会穿孔,避免滤纸穿孔的措施是 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学可充电池的反应规律(解析版) 题型:选择题
铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,工作原理为Fe3++Cr2+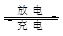 Fe2++Cr3+。下列说法一定正确的是
Fe2++Cr3+。下列说法一定正确的是
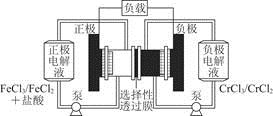
A.充电时,阴极的电极反应式为Cr3++e-=Cr2+
B.电池放电时,负极的电极反应式为Fe2+-e-=Fe3+
C.电池放电时,Cl-从负极室穿过选择性透过膜移向正极室
D.放电时,电路中每流过0.1 mol电子,Fe3+浓度降低0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学化学键与分之间作用力(解析版) 题型:选择题
下列说法正确的是
A.金属元素和非金属元素间形成的化学键一定是离子键
B.ⅦA族元素是同周期元素中非金属性最强的元素
C.全部由非金属元素形成的化合物一定是共价化合物
D.短周期中,同周期元素的离子半径从左到右逐渐减小
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学化学用语与分类(解析版) 题型:选择题
下列物质分类正确的是
A.SO2、SiO2、CO均为酸性氧化物
B.稀豆浆、硅酸、氯化铁溶液均为胶体
C.烧碱、冰醋酸、四氯化碳均为电解质
D.福尔马林、水玻璃、氨水均为混合物
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学化学用语与分类(解析版) 题型:选择题
下列有关分类的观点正确的是
①由苯制取溴苯、硝基苯、环己烷的反应都属于取代反应
②铅蓄电池、锂电池、碱性锌锰电池都属于二次电池
③碳素钢、不锈钢和目前流通的硬币都属于合金
④生物质能、沼气和乙醇都是可再生能源
⑤氨水、醋酸、氢氧化铝都属于弱电解质
A.①② B.②④ C.③④ D.③⑤
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学化学平衡常数(解析版) 题型:填空题
700 ℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)  CO2(g)+H2(g);反应过程中测定的部分数据见下表(表中t2>t1),下列说法正确的是
CO2(g)+H2(g);反应过程中测定的部分数据见下表(表中t2>t1),下列说法正确的是
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 |
|
t2 |
| 0.20 |
A.反应在t1min内的平均速率为v(H2)=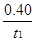 mol·L-1·min-1
mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.40 mol
C.保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小
D.温度升高至800 ℃,上述反应平衡常数为0.64,则正反应为吸热反应
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学化学反应速率的计算、影响因素(解析版) 题型:选择题
如下图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+3B(g)  2C(g) ΔH=-192 kJ·mol-1。向M、N中,分别通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是
2C(g) ΔH=-192 kJ·mol-1。向M、N中,分别通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是

A.若平衡时A气体在两容器中的体积分数相等,则x一定等于y
B.若x∶y=1∶2,则平衡时,M中的转化率:A>B
C.若x∶y=1∶3,当M中放出热量172.8 kJ时,A的转化率为90%
D.若x=1.2,y=1,N中达到平衡时体积为2 L,含有C 0.4 mol,再通入0.36 mol A时,v正<v逆
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com