
【题目】NaClO、NaNO3、Na2SO3等钠盐在多领域有着较广的应用。
(1)上述三种盐所涉及的五种元素中,半径较小的原子是______________;原子核外最外层p亚层上电子自旋状态只有一种的元素是_____________。
(2)碱性条件下,铝粉可除去工业废水中的NaNO2,处理过程中产生一种能使湿润红色石蕊试纸变蓝的气体。产物中铝元素的存在形式_____________(填化学符号);每摩尔铝粉可处理_____________gNaNO2。
(3)新冠疫情发生后,有人用电解食盐水自制NaClO消毒液,装置如图(电极都是石墨)。电极a应接在直流电源的_____________极;该装置中发生的化学方程式为_____________
(4)Na2SO3溶液中存在水解平衡![]() +H2O
+H2O![]()
![]() +
+![]() 设计简单实验证明该平衡存在__________________。0.1mol/L Na2SO3溶液先升温再降温,过程中(溶液体积变化不计)PH如下。
设计简单实验证明该平衡存在__________________。0.1mol/L Na2SO3溶液先升温再降温,过程中(溶液体积变化不计)PH如下。
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
PH | 9.66 | 9.52 | 9.37 | 9.25 |
升温过程中PH减小的原因是_____________;①与④相比;C(![]() )①____________④(填“>”或“<”).
)①____________④(填“>”或“<”).
【答案】O N ![]() 34.5 正 2NaCl+2H2O
34.5 正 2NaCl+2H2O![]() 2NaOH+H2
2NaOH+H2![]() +Cl2
+Cl2![]() ,Cl2+2NaOH→NaCl+NaClO+H2 向溶液中滴加酚酞,发现变红 温度升高,Kw 变大,c(H+)增大,pH 变小(Na2SO3被氧化) >
,Cl2+2NaOH→NaCl+NaClO+H2 向溶液中滴加酚酞,发现变红 温度升高,Kw 变大,c(H+)增大,pH 变小(Na2SO3被氧化) >
【解析】
(1)电子层数越少,半径越小,电子层数相同,质子数越多半径越小;p亚层的电子数![]() ,p亚层上电子自旋状态只有一种;根据洪特规则,当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,而且自旋状态相同;
,p亚层上电子自旋状态只有一种;根据洪特规则,当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,而且自旋状态相同;
(2)铝在碱性条件下,生成偏铝酸盐;铝粉除去工业废水中的NaNO2,处理过程中产生氨气,反应方程式是![]() ;
;
(3)氯气与氢氧化钠反应生成次氯酸钠,为使氯气与氢氧化钠充分反应,a极应生成氯气;
(4)由于该水解平衡的存在,使Na2SO3溶液显碱性;水电离吸热,升高温度,水的电离平衡正向移动;①与④相比,温度相同,①的pH大于④,说明④中![]() 浓度减小。
浓度减小。
(1)上述三种盐所涉及的五种元素中,Na、Cl、S有3个电子层,半径较大,O、 N有2个电子层,且O的质子数大于N,所以半径较小的原子是O;根据洪特规则,当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,而且自旋状态相同,所以p亚层上电子自旋状态只有一种的元素是N;
(2)铝在碱性条件下,生成偏铝酸盐,产物中铝元素的存在形式是![]() ;铝粉除去工业废水中的NaNO2,反应方程式是
;铝粉除去工业废水中的NaNO2,反应方程式是![]() ,根据方程式1molAl粉处理0.5mol NaNO2,质量是0.5mol×69g/mol=34.5g;
,根据方程式1molAl粉处理0.5mol NaNO2,质量是0.5mol×69g/mol=34.5g;
(3)a极氯离子失电子生成氯气,所以a极是阳极,应接在直流电源的正极;用石墨电极电解饱和食盐水生成氢氧化钠、氢气、氯气,氯气与氢氧化钠反应生成次氯酸钠,该装置中发生的化学方程式为2NaCl+2H2O![]() 2NaOH+H2
2NaOH+H2![]() +Cl2
+Cl2![]() ,Cl2+2NaOH=NaCl+NaClO+H2O;
,Cl2+2NaOH=NaCl+NaClO+H2O;
(4)该水解平衡的存在,Na2SO3使溶液显碱性,向溶液中滴加酚酞,发现变红,则证明该平衡的存在;水电离吸热,升高温度,水的电离平衡正向移动,Kw 变大,c(H+)增大,pH 变小; ①与④相比,温度相同,①的pH大于④,说明④中![]() 浓度减小,c (
浓度减小,c (![]() )①>④。
)①>④。


科目:高中化学 来源: 题型:
【题目】工业碳酸钠(纯度约为98%)中常含有Ca2+、Mg2+、Fe3+、Cl-和S![]() 等杂质,为了提纯工业碳酸钠,并获得试剂级碳酸钠的简要工艺流程如图:
等杂质,为了提纯工业碳酸钠,并获得试剂级碳酸钠的简要工艺流程如图:

已知:碳酸钠的饱和溶液在不同温度下析出的溶质如图所示:
![]()
(1)热的Na2CO3溶液有较强的去油污能力,其原因是(用离子方程式及必要的文字加以解释______。
(2)“趁热过滤”时的温度应控制在______。
(3)已知:Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g) ΔH=+532.36 kJ· mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g) ΔH=+473.63kJ· mol-1
写出Na2CO3·H2O脱水反应的热化学方程式:_____________。
(4)有人从“绿色化学”角度设想将“母液”沿流程图中虚线所示进行循环使用,请你分析实际生产中是否可行:______,其理由是____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】达喜是常用的中和胃酸的药物,其有效成分是含结晶水的铝镁碱式盐。取该碱式盐6.02g,向其中逐滴加入4.00mol·L-1的盐酸,当加入盐酸42.5mL时开始产生CO2,加入盐酸至45.0mL时恰好反应完全。
(1)计算该碱式盐样品中碳酸根与氢氧根的物质的量之比:__。
(2)若达喜中镁、铝元素的物质的量之比为3:1,则氢元素的质量分数为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某样品中氟元素的质量分数进行如下实验,利用高氯酸(高沸点酸)将样品中的氟元素转化为氟化氢(氢氟酸为低沸点酸,含量低,不考虑对玻璃仪器的腐蚀),用水蒸气蒸出,再通过滴定测量。实验装置如下图所示,加热装置省略。
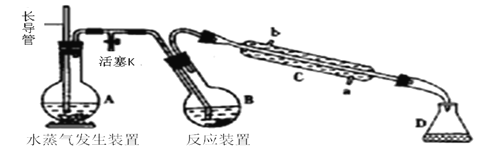
(1) 仪器C名称是___________,长导管作用是_____________________________。
(2)实验时,首先打开活塞K,待水沸腾时,关闭活塞K,开始蒸馏。若蒸馏时因反应装置局部堵塞造成长导管水位急剧上升,应立即______________________。
(3)连接水蒸气发生装置和反应装置之间的玻璃管常裹以石棉绳,其作用是________。
(4)B中加入一定体积高氯酸和1.00g 氟化稀土矿样,D中盛有滴加酚酞的NaOH溶液。加热A、B,使A中产生的水蒸气进入B。
①下列物质不可代替高氯酸的是___________(填标号)
a. 硫酸 b.硝酸 c.磷酸 d.乙酸 e.盐酸
②D中主要反应的离子方程式为_________________________________。
(5)向馏出液中加入25.00mL0.1000mol·L-1La(NO3)3溶液,得到LaF3沉淀(La3+不发生其他反应),再用0.1000 mol· L-1EDTA标准溶液滴定剩余La3+(La3+与EDTA按1︰1发生络合反应),消耗EDTA标准溶液平均19.80mL,则氟化稀土样品中氟的质量分数为______(百分数保留小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化合物2苯基丙烯(![]() ),下列说法正确的是
),下列说法正确的是
A. 不能使稀高锰酸钾溶液褪色
B. 可以发生加成聚合反应
C. 分子中所有原子共平面
D. 易溶于水及甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知无水FeCl3能与氯苯反应:2FeCl3+C6H5Cl=2FeCl2+C6H4Cl2+HCl↑,实验室利用该装置制备无水FeCl2并检测FeCl3的转化率。已知:C6H5Cl、C6H4Cl2沸点依次为132℃、173℃。如图为制备FeCl2装置(加热和加持仪器省略)
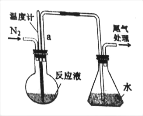
(1)蒸干并灼烧FeCl2溶液最终得到_____
(2)导管a的作用是_____;反应前通入N2的作用是_____;
(3)锥形瓶的作用是_____;该装置的不足之处为_____。
(4)反应结束后,回收过量氯苯的操作方法名称是_____。
若32.500g无水FeCl3与过量氯苯充分反应后将锥形瓶内溶液配制成250mL溶液,量取其中25.00mL溶液,滴加指示剂后,用0.4000mol/L的NaOH溶液滴定,重复三次,达到滴定终点平均消耗19.60mLNaOH溶液。
(5)滴定终点的现象是_____。
(6)FeCl3的转化率(转化量占总量的百分率)为_____%。
若制备反应后未通入足量N2,测定结果会_____(选项:偏高、偏低或不影响)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是 ( )

A. 根据图①溶解度与溶液pH关系,若除去CuSO4溶液中的Fe3+可向溶液中加入适量Cu,至pH在4左右。
B. 图②可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
C. 图③表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
D. 根据图④可判断可逆反应A2(g)+3B2(g)![]() 2AB3(g)的化学平衡常数K随温度升高而变小
2AB3(g)的化学平衡常数K随温度升高而变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中化学知识无处不在,下列化学知识的说法正确的是( )
A.在“新冠肺炎战疫”中,用于消毒的“84”消毒液的有效成分NaClO只含离子键
B.医用消毒酒精中乙醇的浓度为 75%,乙醇的官能团是-OH,1mol -OH 含 10mol 电子
C.可用于杀菌消毒的双氧水中过氧化氢的电子式为 ![]()
D.用于衡量一个国家石油化工水平标志的乙烯结构简式为 CH2CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列叙述正确的是
A.1molCl2发生反应时,转移的电子数一定为2NA
B.1.7g H2O2中含有的电子数为0.9 NA
C.1mol Na2O2 固体中含离子总数为4 NA
D.标准状况下,2.24L苯所含分子数为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com