
| A. | 工业制粗硅 | B. | 湿法炼铜 | ||
| C. | 用稀盐酸与石灰石反应制取CO2 | D. | 稀硫酸与锌粒反应制取氢气 |
分析 发生的化学反应中,若存在元素的化合价变化,则属于氧化还原反应,反之,不存在元素的化合价变化,不属于氧化还原反应,以此来解答.
解答 解:A、工业制粗硅,发生C和二氧化硅的反应,C、Si元素的化合价变化,属于氧化还原反应,故A不选;
B、湿法冶金炼铜就是铁和硫酸铜溶液反应,生成硫酸亚铁和铜,故答案为:Fe+CuS04=Cu+FeSO4,故B不选;
C、用稀盐酸与石灰石反应制取CO2,是非氧化还原反应,故C选;
D、稀硫酸与锌粒反应制取氢气,有单质参加和生成的反应是氧化还原反应,故D不选;
故选C.
点评 本题考查氧化还原反应,为高考常见题型,把握发生的化学反应及元素的化合价变化为解答的关键,注意化工生产中涉及的化学反应,题目难度不大.


科目:高中化学 来源: 题型:选择题
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | amol | 0 | 0 |
| A. | 当通入Cl2的体积为2.8L时,只有I-与Cl2发生反应 | |
| B. | 当通入Cl2的体积为2.8-5.6L时,只有Br-与Cl2发生反应 | |
| C. | a=0.15 | |
| D. | 原溶液中c(Cl-):c(Br-):c(I-)=10:15:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | |
| Z | W |
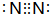 ;Y和氢元素形成的10电子微粒中常见的+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子为HS-;
;Y和氢元素形成的10电子微粒中常见的+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子为HS-;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
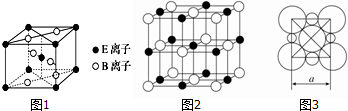
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | NH3•H2O | C. | ZnO | D. | ZnCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,A在一定条件下能与水反应,可用于饮用水的消毒,试写出此反应的化学反应方程式NCl3+3H2O=NH3+3HClO.
,A在一定条件下能与水反应,可用于饮用水的消毒,试写出此反应的化学反应方程式NCl3+3H2O=NH3+3HClO.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在饱和氯水中:Cl-、NO3-、Na+、SO32- | |
| B. | 0.1mol/L NaAlO2溶液中:K+、CO32-、SO42-、Cl- | |
| C. | 在强碱性溶液中:Na+、NH4+、SO32-、Cl- | |
| D. | 1.0mol•L-1的盐酸溶液中:K+、Fe2+、ClO-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2→Na2CO3 | B. | Na2CO3→HCl | C. | Na2CO3→Ca(OH)2 | D. | 水→BaCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com