
【题目】核内中子数为N的R2+,质量数为A,则ng它的同价态氧化物中所含电子物质的量为( )
A.![]() (A+N-10)molB.
(A+N-10)molB.![]() (A-N+6)mol
(A-N+6)mol
C.(A-N+2)molD.![]() (A-N+8)mol
(A-N+8)mol
科目:高中化学 来源: 题型:
【题目】一种用铝土矿和硫铁矿烧渣(配料中含Al2O3、Fe2O3,FeO及SiO2等)为原料制备无机高分子絮凝剂聚合碱式氯化铝铁的流程如下:
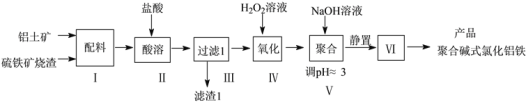
(1)步骤Ⅱ酸溶时,Fe2O3被溶解的化学程式为____,滤渣1的成分为____(填化学式)。
(2)步骤Ⅳ发生反应的离子方程式为________________。
(3)步骤V若将溶液pH调成6,可能造成的影响是_______;步骤Ⅵ包含的操作有_______。
(4)测定聚合碱式氯化铝铁{可表示为[FeaAlb(OH)xCly]n}中n(Al)/n(Fe)的比值的步骤如下:
步骤1.准确称取产品5.710g溶于水,加入足量的稀氨水,过滤,将滤渣灼烧至质量不再变化,得到3.350 g固体。
步骤2.另准确称取2.855g样品,溶于足量NaOH溶液,过滤,充分洗涤,将滤渣灼烧至质量不再变化,得到固体0.4000g。
计算产品中n(Al)/n(Fe)的比值(写出计算过程)。__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求计算并填空
(1)32gSO2标况下的体积为____________L,含有______________个氧原子。
(2)1.204×1023个NH3分子所含的氢原子数与________mol CH4含有的氢原子数相同。
(3)标况下,某CO2和H2混合气体的密度为1.25g/L,则混合气体中CO2和H2的体积比约为______________。
(4)200 mL某硫酸盐溶液中含SO42- 1.5 NA个,含金属离子NA个,则该硫酸盐溶液的物质的量浓度为________mol/L。
(5)把VmL含有Al2(SO4)3和(NH4)2SO4的混合溶液分成两等份,一份加入含足量NaOH的溶液并加热,铵根离子完全反应生成a mol NH3(已知NH4++OH-![]() NH3↑+H2O);另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中Al3+的浓度为_____________mol/L。
NH3↑+H2O);另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中Al3+的浓度为_____________mol/L。
(6)将20.0g质量分数为14.0%的 NaNO3溶液与30.0g质量分数为24.0%的NaNO3溶液混合,得到的密度为1.15g/cm3的混合溶液。混合后溶液的物质的量浓度为______(结果保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图的装置进行电解实验:A极是铜锌合金,B为纯铜。电解质溶液中含有足量的铜离子。通电一段时间后,若A极恰好全部溶解,此时B极质量增加9.6g,溶液质量增加0.05g,则A极合金中Cu、Zn原子个数比为

A. 4:1 B. 1:1 C. 2:1 D. 任意比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2 -e— + OH- = NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
丹参素是中药丹参的水溶性成分,结构为 F ,具有扩张血管、增加冠脉血流量等作用,某一种合成路线如下图所示:

已知:![]()
![]()
(1)丹参素的分子式为____________; D →E 的反应类型是_______________。
(2)试剂X是____________(写化学式);C 中含氧官能团名称为_____________。
(3) A→B 的反应方程式为________________。
(4)G与 E互为同分异构体,请写出满足下列条件的任意两种G的结构简式______________。
①lmolG 能与4molNaOH发生反应;
②能够发生水解反应;
③核磁共振氢谱显示5个吸收峰,且峰面积之比为 1 : 2 : 2 : 2 : 3 。
(5)参考上述流程信息,设计以![]() 、CH3CHO为原制取
、CH3CHO为原制取![]() 的合成路线(其它无机试剂任选)。________________
的合成路线(其它无机试剂任选)。________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将AgNO3溶液分别滴加到浓度均为0.01mol/L的NaBr、Na2SeO3溶液中,所得的沉淀溶解平衡曲线如图所示(Br-、SeO32-用Xn-表示,不考虑SeO32-的水解)。下列叙述正确的是

A. Ksp(Ag2SeO3)的数量级为10-10
B. d点对应的AgBr溶液为不饱和溶液
C. 所用AgNO3溶液的浓度为10-3 mol/L
D. Ag2SeO3(s)+2Br-(aq)==2AgBr(s)+SeO32- (aq)平衡常数为109.6,反应趋于完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有铁的氧化物样品,用150 mL 5 mol/L的盐酸恰好使其完全溶解,所得溶液还能吸收标准状况下氯气1.68L,使其中的Fe2+全部转化为Fe3+,该样品可能的化学式是( )
A.Fe2O3B.Fe3O4C.Fe5O7D.Fe4O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的刚性密闭容器中,加入1mol CO2和3mol H2,发生反应CO2+3H2CH3OH+H2O.在其他条件不变的情况下,温度对反应的影响结果如图所示(注:T1、T2均大于300℃)。下列说法正确的是

A. 该反应在T1时的平衡常数比T2时的小
B. 处于A点的反应体系从T1变到T2,达到平衡时![]() 减小
减小
C. T2下,反应达到平衡时生成甲醇的平均速率为v(CH3OH)=![]() molL﹣1min﹣1
molL﹣1min﹣1
D. T1下,若反应达到平衡后CO2转化率为a,则容器内的压强与起始压强之比为(2﹣a):2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com