

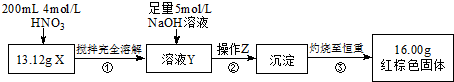
分析 (1)除杂的原则:除去杂质,不能引人新的杂质;操作②是沉淀硫酸根离子的作用,也可以加入氢氧化钡溶液,引入的OH-在加入盐酸后可除去;
(2)钡离子能够与硫酸根离子产生硫酸钡沉淀,据此解答;
(3)加Na2CO3溶液可和过量的钡离子形成沉淀,过量的碳酸根离子和盐酸反应,生成二氧化碳和水;
(4)若过滤与加盐酸的顺序颠倒,碳酸钡与盐酸反应生成可溶性的钡盐,引进的Ba2+无法去除.
解答 解:(1)操作②是完全沉淀硫酸根离子,原则是加入的试剂不能引入新的杂质,或最后易于除去,除了用BaCl2溶液外,也可以用Ba(OH)2溶液,因为改用的Ba(OH)2引入的OH-在加入盐酸后可除去,
故答案为:可以,因为改用的Ba(OH)2引入的OH-在加入盐酸后可除去;
(2)加入过量氯化钡溶液,如果硫酸根离子为完全除去,则仍然含有硫酸根离子,能够与钡离子反应生成沉淀,所以检验硫酸根离子已除尽,可静止片刻在上层清液处,滴加一滴氯化钡溶液,不出现浑浊就说明硫酸根离子已经除尽;
故答案为:取上层清液加BaCl2溶液,如无沉淀出现则说明SO42-已除尽,反之则有;
(3)操作③是加入碳酸钠溶液,目的是除去过量的钡离子,避免引入钡离子杂质,所以加入碳酸钠的目的是除去过量的Ba2+,反应的离子方程式为:Ba2++CO32-=BaCO3↓,加盐酸,除去过量的碳酸根离子CO32-+2H+=H2O+CO2↑,
故答案为:Ba2++CO32-=BaCO3↓;CO32-+2H+=H2O+CO2↑;
(4)若过滤与加盐酸的顺序颠倒,碳酸钡与盐酸反应BaCO3+2HCl=BaCl2+H2O+CO2↑,生成可溶性的钡盐,引进的Ba2+无法去除,
故答案为:引进的Ba2+无法去除.
点评 本题考查了氯化钠的分离与提纯,是高考频考点,明确杂质离子的性质和除杂的原则是解题关键,题目难度中等,试题培养了学生分析问题、解决问题的能力及灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 加入BaCl2溶液产生白色沉淀 | B. | 加入碘水不变蓝 | ||
| C. | 加入BaCl2溶液没有白色沉淀产生 | D. | 加入碘水变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al>Mg=Fe>Na | B. | Al=Mg=Fe=Na | C. | Na>Al>Mg>Fe | D. | Al=Mg=Fe<Na |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在c(HCO${\;}_{3}^{-}$)=0.1 mol•L-1的溶液中:NH${\;}_{4}^{+}$、Al3+、Cl-、NO${\;}_{3}^{-}$ | |
| B. | 有大量NO${\;}_{3}^{-}$存在的强酸性溶液中:NH${\;}_{4}^{+}$、Ba2+、Fe3+、Cl- | |
| C. | 由水电离出的c(H+)=1×10-12mol•L-1的溶液中:Na+、Al3+、CH3COO-、I- | |
| D. | 能使pH试纸变红的溶液中:ClO-、S2-、Na+、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  装置用于检验溴丙烷消去产物 | |
| B. |  装置用于石油的分馏 | |
| C. |  装置用于实验室制硝基苯 | |
| D. |  装置可装置证明酸性:盐酸>碳酸>苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管1中,注入浓盐酸,微热 | 黑色粉末逐渐溶解,溶液呈黄绿色;有气泡产生 |
| ② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液出现血红色 |
| ③ | 另取少量黑色粉末X放入试管2中,注入足量硫酸铜溶液,振荡,静置 | 有极少量红色物质析出,仍有较多黑色固体未溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+、Cu2+、Fe3+、Al3+、Fe2+ |
| 阴离子 | Cl-、CO32-、NO3-、SO42-、SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH-CH3 | B. | CH2=CH-CH2-CH3 | ||
| C. | CH3=CH-CH2-CH=CH2 | D. | CH2=CH-CH2-CH2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com