
| A. | 乙醇、乙酸都能与钠反应 | |
| B. | 乙醇、乙酸互为同分异构体 | |
| C. | 乙醇、乙酸都是高分子化合物 | |
| D. | 乙醇、乙酸都能使紫色石蕊试液变红色 |
分析 A.乙醇含有羟基,乙酸含有羧基,都能与钠反应生成氢气;
B.乙醇、乙酸的分子式不同;
C.高分子化合物的相对分子质量一般在一万以上;
D.乙醇没有酸性,乙酸具有酸性.
解答 解:A.乙醇含有羟基,乙酸含有羧基,都能与钠反应生成氢气,故A正确;
B.二者分子式不同,不是同分异构体,故B错误;
C.乙醇和乙酸的相符分子质量较小,达不到高分子化合物的级别,不是高分子化合物,故C错误;
D.乙醇不具有酸性,不能使紫色溶液变红色,故D错误;
故选A.
点评 本题考查有机物的结构和性质,侧重于学生的分析能力的考查,为高考常见题型,注意把握有机物的官能团的性质,把握乙醇和乙酸的性质的区别,难度不大.


科目:高中化学 来源: 题型:解答题
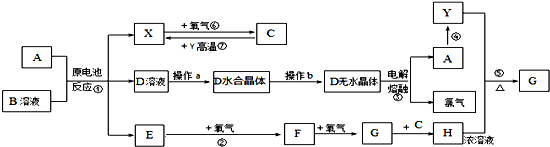
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
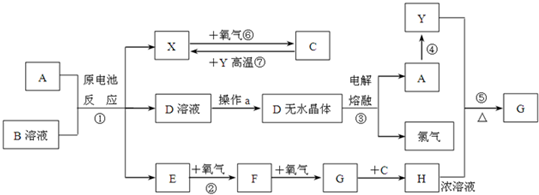
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
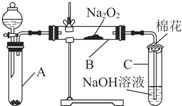 为了探究SO2与Na2O2的反应是否类似于CO2与Na2O2的反应,甲同学设计了如图所示的实验装置,回答下列问题:
为了探究SO2与Na2O2的反应是否类似于CO2与Na2O2的反应,甲同学设计了如图所示的实验装置,回答下列问题:| 实验步骤 | 预期现象和结论 |
| 步骤1:取B中的少量固体样品于试管中,滴加足量蒸馏水,溶解,然后取少量待测液分别置于Ⅰ、Ⅱ试管中 | 固体完全溶解 |
| 步骤2:往Ⅰ试管中加入1mol•L-1盐酸,再滴加1mol•L-1BaCl2溶液 | 有白色沉淀生成,则证明生成物中含Na2SO4, |
| 则证明生成物中含Na2SO4 | |
| 步骤3:往Ⅱ试管中加入2~3滴0.01mol•L-1KMnO4酸性溶液, | |
| 振荡 | 若KMnO4溶液紫红色褪去,则证明生成物中有Na2SO3;, |
| 则证明生成物中有Na2SO3;若 | |
| 若KMnO4溶液紫红色不褪去, | |
| 则说明生成物中没有Na2SO3. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>X>Y | |
| B. | 最高价氧化物对应水化物的酸性强弱:R>W>X | |
| C. | Y的氢化物比R的氢化物稳定,熔沸点高 | |
| D. | Y与Z形成的两种化合物中阴、阳离子的个数比均为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
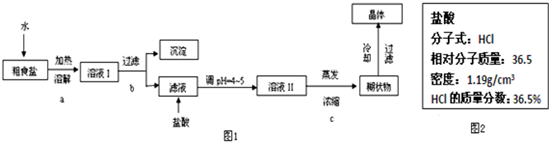
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 硫酸溶液中加入少量Ba(OH)2溶液:SO42-+Ba2+═BaSO4 | |
| C. | 用稀硫酸洗去铁锈:Fe2O3+6H+═2Fe3++3H2O | |
| D. | 硝酸汞溶液与铝反应:Hg2++Al3+═Al3++Hg |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁、铝、铜及其化合物在生产、生活中有广泛的用途,试回答下列问题:
铁、铝、铜及其化合物在生产、生活中有广泛的用途,试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com