
| A、将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 |
| B、用碱式滴定管量取20.00mL0.1mol/LKMnO4溶液 |
| C、向沸腾的NaOH溶液中滴加FeCl3溶液,制备Fe(OH)3胶体 |
| D、配制FeSO4溶液时,需加入少量铁粉和稀硫酸 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、①④ | B、②⑤ | C、③④ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、D的质量不再改变 |
| B、各组分的浓度不再改变 |
| C、反应速率υA:υB:υC:υD=m:n:p:q |
| D、单位时间内m mol A断键发生反应,同时p mol C也断键发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
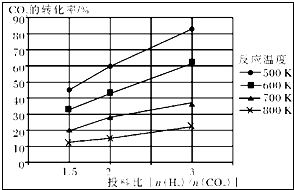
| 1 |
| 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向CH3CH2X中加入少量AgNO3溶液,加热 | 有浅黄色沉淀生成 | CH3CH2X中含有Br- |
| B | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热, | 没有红色沉淀生成 | 淀粉没有水解成葡萄糖 |
| C | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈强碱性 |
| D | 滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中含有I- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | 第二周期中一种非金属元素,第一电离能大于相邻元素 |
| B | 2P轨道上有二个孤电子 |
| C | 与B同主族 |
| D | 前四周期中金属性最强的元素 |
| E | 前四周期中原子核外孤电子数最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
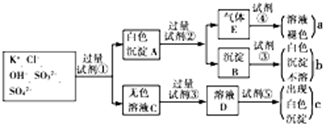
查看答案和解析>>
科目:高中化学 来源: 题型:
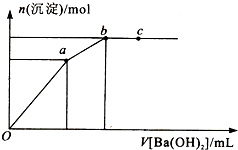 向100mL 0.1mol?L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液中逐滴滴入0.1mol?L-1Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如下图所示.则下列说法中正确的是( )
向100mL 0.1mol?L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液中逐滴滴入0.1mol?L-1Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如下图所示.则下列说法中正确的是( )| A、a点时溶液中所含主要溶质为(NH4)2SO4 |
| B、a→b段发生反应的离子方程式是:SO42-+Ba2+=BaSO4↓ |
| C、b点为最大沉淀量,对应的纵坐标值为0.2 |
| D、c点加入Ba(OH)2溶液的体积为200 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将此溶液稀释106倍,溶液的pH=6 |
| B、与等体积等浓度的氯化铵溶液混合后所得溶液呈中性 |
| C、与pH=2的CH3COOH溶液任意比混合:c(H+)+c(Na+)=c(OH-)+c(CH3COO-) |
| D、与0.01 mol?L-1 的CH3COOH溶液等体积混合所得溶液中:c (Na+)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com