
【题目】北京时间11月1日清晨5时58分07秒,中国“长征二号F”遥八运载火箭在酒泉卫星发射中心载人航天发射场点火发射,火箭的第三级使用的推进剂是液氢和液氧。
已知下面在298K时的热化学方程式:
2H2(g)+O2(g)== 2H2O(l) ΔH=-571.6 kJ·mol-1
CH4(g)+2O2(g)==CO2(g)+2H2O (l)ΔH=-890.3 kJ·mol-1
C(s)+O2(g)== CO2(g)ΔH=-393.5 kJ·mol-1
根据上面的热化学方程式完成下列问题:
(1)通过计算说明等质量的H2、C、CH4完全燃烧时放出热量最多的是_________。
(2)根据以上反应,则C(s)+2H2(g)== CH4(g)的焓变ΔH=________________。
(3)已知H2O(l)== H2O(g) ΔH=+44.0 kJ·mol-1
试写出甲烷燃烧生成二氧化碳和水蒸气的热化学方程式:________________
【答案】 H2 -74.8 kJ·mol-1 CH4(g)+2O2(g)==CO2(g)+2H2O(g) ΔH=-802.3 kJ·mol-1
【解析】分析:(1)根据热化学方程式的含义以及对应的反应热进行计算;
(2)根据盖斯定律来计算化学反应的焓变;
(3)根据盖斯定律来解答。
详解:(1)设质量都为m,根据热化学方程式可知相同质量的H2、CH4、C完全燃烧时,放出热量分别是![]() 、
、![]() 、
、![]() 、最大值应为
、最大值应为![]() ,因此相同质量的H2、CH4、C完全燃烧时,放出热量最多的是H2;
,因此相同质量的H2、CH4、C完全燃烧时,放出热量最多的是H2;
(2)已知:
①2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
②CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
③C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
根据盖斯定律可知①+③-②得热化学方程式为C(s)+2H2(g)=CH4(g)△H=-74.8 kJmol-1;
(3)已知:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
②H2O(l)=H2O(g) ΔH=+44.0 kJ·mol-1
根据盖斯定律可知①+②×2即得到热化学方程式CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3 kJmol-1。


科目:高中化学 来源: 题型:
【题目】实验室制取乙烯并检验乙烯性质的装置如图. 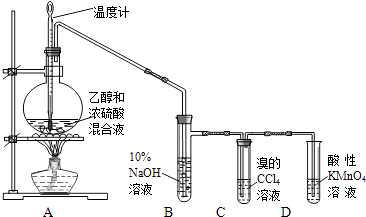
请回答有关问题:
(1)烧瓶中除反应物以外,还应放2﹣3块碎瓷片,目的是 .
(2)烧瓶中产生乙烯的反应方程式为 .
(3)反应开始后,可观察到C和D中共同的现象是;
C中的反应类型为反应、D中的反应类型为反应.
(4)反应结束冷却至室温,处理烧瓶中废液发现,反应液变黑、且有强烈的刺激性气味气体,其原因是;10%的NaOH溶液起的作用是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据问题填空:
(1)已知下列两个热化学方程式: C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=﹣2220.0kJmol﹣1
H2O(l)=H2O(g)△H=+44.0kJmol﹣1则0.5mol C3H8燃烧生成CO2和气态水时释放的热量为kJ.
(2)已知:①CO(g)+ ![]() O2(g)=CO2(g)△H=﹣283.0kJmol﹣1②CH3OH(l)+
O2(g)=CO2(g)△H=﹣283.0kJmol﹣1②CH3OH(l)+ ![]() O2(g)=CO2(g)+2H2O(l)△H=﹣726.5kJmol﹣1
O2(g)=CO2(g)+2H2O(l)△H=﹣726.5kJmol﹣1
请写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: .
(3)科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似.已知断裂1molN﹣N键吸收193kJ热量,断裂1molN≡N键吸收941kJ热量,则1molN4气体转化为2molN2时的△H= . (填﹣724kJmol﹣1或+724kJmol﹣1) 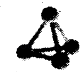
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将适量铁粉放入FeCl3溶液中,完全反应后,溶液中的Fe2+和Fe3+浓度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比是( )
A. 2∶3 B. 3∶2
C. 1∶2 D. 1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH。请回答下列问题:
3Zn(OH)2+2Fe(OH)3+4KOH。请回答下列问题:
(1)高铁电池的负极材料是____。
(2)放电时,正极发生____(填“氧化”或“还原”)反应;已知负极反应为Zn-2e-+2OH-====Zn(OH)2,则正极反应为_______________________。
(3)放电时,____(填“正”或“负”)极附近溶液的碱性增强。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬及其化合物工业用途广泛,但含+6价铬的污水会损害环境,必须进行处理。某工厂的处理工艺流程如下:
![]()
(1)N2H4的电子式为___________。
(2)下列溶液中,可以代替上述流程中N2H4的是___________。(填选项序号)
A.FeSO4溶液 B.浓HNO3溶液 C.酸性KMnO4溶液 D.Na2SO3溶液
(3)已知加入N2H4的流程中,N2H4转化为无污染的物质,则该反应中氧化剂与还原剂的物质的量之比为___________。
(4)在实际的含铬废水处理中,还可采用直接沉淀的方法,处理成本较低。
①已知含铬酸性废水中存在着Cr2O72-和CrO42-相互转化的平衡,请用离子方程式表示它们之间的转化反应___________;
②在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成的沉淀为____________写化学式)。
(5)工业上可用电解法来处理含Cr2O![]() 的酸性废水。具体方法是首先通过电解制得还原剂,然后还原剂将Cr2O
的酸性废水。具体方法是首先通过电解制得还原剂,然后还原剂将Cr2O![]() 还原为Cr3+,最终转化成Cr(OH)3沉淀而除去。如图为电解装置示意图(电极材料分别为铁和石墨)。
还原为Cr3+,最终转化成Cr(OH)3沉淀而除去。如图为电解装置示意图(电极材料分别为铁和石墨)。

①装置中b电极的材料是________(填“铁”或“石墨”)。
②上述处理过程中,Cr2O![]() 被还原成Cr3+的离子方程式为_______________________。
被还原成Cr3+的离子方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。五种元素均位于短周期,X、W的质子数之和为23。下列说法正确的是
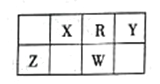
A. Y元素的最高价氧化物对应的水化物是含氧酸中酸性最强的
B. W和R只能形成一种化合物WR3,且为酸性氧化物
C. Z的气态氢化物稳定性强于W的气态氢化物
D. Z与R形成的化合物ZR2是生产光纤制品的基本原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量浓度相同的CH3COOH和NaOH溶液混合后,溶液中c(CH3COO﹣)=c(Na+),则醋酸体积氢氧化钠溶液体积(填“>”或“=”或“<”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接排放含SO2会形成酸雨,危害环境。某化学实验小组用如下装置进行有关SO2性质的探究活动。
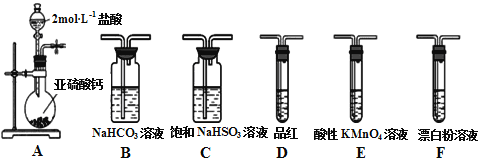
(1)装置A中反应的离子方程式为___________________________________。
(2)选用以上装置和药品探究亚硫酸与次氯酸的酸性强弱:甲同学认为按照A→C→F→尾气处理顺序连接装置可以证明,乙同学认为该方案不合理,其理由是___________________。正确的连接顺序是:A→C→___________→尾气处理(填字母)顺序连接装置。证明亚硫酸的酸性强于次氯酸的酸性的实验现象是__________________________。
(3)将二氧化硫通入以下装置可以制备Na2S2O3:

①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是________________。
②写出装置A中发生反应的化学方程式___________________________________。
③Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:
第一步:准确称取a g KIO3(化学式量:214)固体配成溶液;
第二步:加入过量KI固体和H2SO4溶液,滴加指示剂;
第三步:用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为V mL。则c(Na2S2O3)=____mol·L-1。(已知:IO3-+5I-+6H+= 3I2+3H2O, 2S2O32-+I2=S4O62-+2I-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com