
| A、BF3是三角锥形分子 | ||
B、NH
 ,离子呈平面形结构 ,离子呈平面形结构 | ||
| C、CH4分子中的4个C-H键都是氢原子的1s轨道与碳原子的p轨道形成的s-p σ键 | ||
| D、CH4分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个s-sp3σ键 |
| 3-3 |
| 2 |
 ,N原子呈4个N-Hσ键,没有孤电子对,故其正四面体结构,故B错误;
,N原子呈4个N-Hσ键,没有孤电子对,故其正四面体结构,故B错误;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、1mol氯化铯中有N 个CsCl分子 |
| B、氯化铯晶体中,每个Cs+周围距离相等的Cs+共有6个 |
| C、氯化铯晶体中,每个Cs+周围紧邻8个C1- |
| D、平均每个Csc1晶胞中有1个Cs+、1个C1- |
| E、平均每个Csc1晶胞中有1个Cs+、1个C1- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KCl中含有35Cl |
| B、生成物Cl2的相对分子质量为73.3 |
| C、该反应转移的电子数为6e- |
| D、氧化剂和还原剂的物质的量之比为1:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(NH4)2SO4和CuSO4溶液都能使蛋白质沉淀析出 |
B、苯酚与甲醛在酸性条件下生成酚醛树脂的结构简式为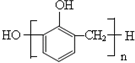 |
| C、醋酸和硬脂酸互为同系物,C6H14和C9H20也一定互为同系物 |
D、叶酸的结构为 ,它可以发生酯化、水解、加成等反应 ,它可以发生酯化、水解、加成等反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)铅蓄电池是典型的二次电池,由于铅蓄电池的性能优良、价格低廉、安全可靠,可多次充放电,所以在生产生活中使用广泛,总反应式是pb+pbo2+4H++2SO42-
(1)铅蓄电池是典型的二次电池,由于铅蓄电池的性能优良、价格低廉、安全可靠,可多次充放电,所以在生产生活中使用广泛,总反应式是pb+pbo2+4H++2SO42-| 放电 |
| 充电 |
| 电池 | 电解池 | |
| A | H+移向pb电极 | H+移向pb电极 |
| B | 每消耗3mol pb | 生成2molAl2O3 |
| C | 正极:pbO2+4H++2e-=pb2++2H2O | 阳极:2AL+3H2O-6e-═AL2O3+6H+ |
| D |  | 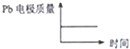 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学反应 | 平衡常数 | 温度 | |
| 973K | 1173K | ||
| ①Fe(s)+CO2(g)?FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| ②Fe(s)+H2O(g)?FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
| ③CO(g)+H2O(g)?CO2(g)+H2(g) | K3 | ? | ? |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com