
| A. | 向被污染的土壤洒石灰 | |
| B. | 向远离污染源的高处撤离 | |
| C. | 用浸有纯碱溶液的毛巾捂住口鼻迅速撤离 | |
| D. | 来不及撤离时可用纯碱溶液浸湿的棉被堵好门窗 |
分析 A.石灰溶于水形成氢氧化钙是碱溶液可以吸收氯气;
B.氯气密度比空气重;
C.纯碱是碳酸钠溶液可以和氯气发生反应吸收氯气;
D.纯碱是碳酸钠溶液可以和氯气发生反应吸收氯气;
解答 解:A.石灰溶于水形成氢氧化钙是碱溶液可以吸收氯气,利用的是氯气的化学性质,故A错误;
B.氯气密度比空气重,发生CI2泄漏向远离污染源的高处撤离,故B正确;
C.纯碱是碳酸钠溶液可以和氯气发生反应吸收氯气,氯气密度比空气重用浸有纯碱溶液的毛巾捂住口鼻迅速撤离,故C错误;
D.纯碱是碳酸钠溶液可以和氯气发生反应吸收氯气,来不及撤离时可用纯碱溶液浸湿的棉被堵好门窗,故D错误;
故选B.
点评 本题考查了氯气的物理性质、化学性质及其性质的应用,掌握基础是解题关键,题目较简单.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | 最外层电子占核外电子总数的$\frac{3}{8}$ |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
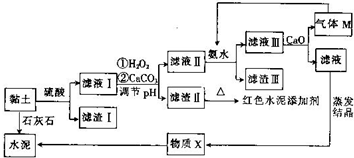 土壤是人类赖以生存的最基本物质,以黏土为原料生产的产品伴随着人类文明的脚步.皖北名胜皇藏峪的黏土,水浸不塌,是生产无机非金属材料的优质原料.某兴趣小组以当地黏土为原料探究彩色水泥、轻质耐火材料的联合生产,其设计的流程如图所示.
土壤是人类赖以生存的最基本物质,以黏土为原料生产的产品伴随着人类文明的脚步.皖北名胜皇藏峪的黏土,水浸不塌,是生产无机非金属材料的优质原料.某兴趣小组以当地黏土为原料探究彩色水泥、轻质耐火材料的联合生产,其设计的流程如图所示.| Fe(OH)2 | Fe(OH)3 | Al(OH)3 | |
| 开始沉淀时的pH | 6.3 | 1.9 | 3.4 |
| 完全沉淀时的pH | 8.3 | 3.2 | 4.7 |
 ;向滤液Ⅲ中加放CaO的作用是与水反应放热,降低NH3的溶解度(任写一条).
;向滤液Ⅲ中加放CaO的作用是与水反应放热,降低NH3的溶解度(任写一条).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
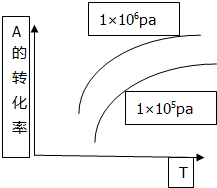 反应mA(g)+B(s)?pC(g)+qD(g)△H>0中A的转化率和温度(T)、压强(P)的关系如图曲线,下列结论正确的是( )
反应mA(g)+B(s)?pC(g)+qD(g)△H>0中A的转化率和温度(T)、压强(P)的关系如图曲线,下列结论正确的是( )| A. | 逆反应为放热反应m<p+q | B. | 逆反应为吸热反应m>p+q | ||
| C. | 正反应为放热反应m<p+q | D. | 正反应为吸热反应m>p+q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该有机物分子中碳、氢、氧原子个数比为1:2:3 | |
| B. | 该有机物分子中碳、氢原子个数比为1:2 | |
| C. | 该有机物中肯定含氧 | |
| D. | 可以判断该有机物中是否含氧 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com