

分析 (1)氨水是弱电解质,不能完全电离,H2S杂质常用氨水吸收,产物为NH4HS,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,反应过程中生成一水合氨,依据原子守恒和电子守恒配平书写化学方程式;
(2)①CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.4kJ•mol-1
②CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1
则①+②得到反应CH4(g)+2H2O(g)?CO2(g)+4H2(g),根据盖斯定律计算焓变;反应①是气体体积增大的吸热反应,一定可以提高平衡体系中H2百分含量,说明平衡正向进行,又能加快反应速率,说明影响反应速率的条件可以是升温、加压、增大浓度等,分析反应特征可知反应正向进行且反应速率增大的只有升温平衡向吸热反应进行,平衡正向进行反应速率增大,依据平衡移动原理和影响反应速率因素分析判断;
(3)依据化学平衡三段式列式计算,转化率=$\frac{消耗量}{起始量}$×100%计算;
(4)依据反应特征N2+3H2=2NH3,反应前后气体体积减小为生成氨气的体积,相同条件下,气体体积比等于气体物质的量之比,图象分析可知平衡状态氨气体积含量42%,设平衡混合气体体积为 100,氨气为体积42,计算反应的氮气,依据气体体积比计算原混合气体中氮气体积,得到平衡状态下氮气体积分数;
(5)合成氨的反应是放热反应,开始反应,氨气物质的量增大,达到平衡状态,继续升温,平衡逆向进行,氨气物质的量减小,据此画出变化图象;
(6)依据反应是气体体积减小的放热反应,结合平衡移动原理分析判断.
解答  解:(1)氨水是弱电解质,不能完全电离,电离方程式为:NH3•H2O?NH4++H2O,H2S杂质常用氨水吸收,产物为NH4HS,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,反应过程中生成一水合氨,依据原子守恒和电子守恒配平书写化学方程式为:2NH4HS+O2$\frac{\underline{\;一定条件\;}}{\;}$2NH3•H2O+2S↓,故答案为:2NH4HS+O2$\frac{\underline{\;一定条件\;}}{\;}$2NH3•H2O+2S↓;
解:(1)氨水是弱电解质,不能完全电离,电离方程式为:NH3•H2O?NH4++H2O,H2S杂质常用氨水吸收,产物为NH4HS,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,反应过程中生成一水合氨,依据原子守恒和电子守恒配平书写化学方程式为:2NH4HS+O2$\frac{\underline{\;一定条件\;}}{\;}$2NH3•H2O+2S↓,故答案为:2NH4HS+O2$\frac{\underline{\;一定条件\;}}{\;}$2NH3•H2O+2S↓;
(2)①CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.4kJ•mol-1
②CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1
则①+②得到:反应CH4(g)+2H2O(g)?CO2(g)+4H2(g),所以焓变△H=206.4kJ•mol-1+(-41.2kJ•mol-1)=+165.2,
反应①CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.4 kJ•mol-1,是气体体积增大的吸热反应,一定可以提高平衡体系中H2百分含量,说明平衡正向进行,又能加快反应速率,说明影响反应速率的条件可以是升温、加压、增大浓度等,分析反应特征可知反应正向进行且反应速率增大的只有升温平衡向吸热反应进行,平衡正向进行反应速率增大;
a.反应是吸热反应,升高温度,反应速率增大,平衡正向进行,平衡体系中H2百分含量增大,故a符合;
b.增大水蒸气浓度,平衡正向进行,反应速率增大,但平衡体系中H2百分含量不一定增大,故b不符合;
c.加入催化剂,改变反应速率不改变化学平衡,反应速率增大,氢气百分含量不变,故c不符合;
d.降低压强,反应速率减小,平衡正向进行,氢气百分含量增大,故d不符合;
故选a;故答案为:+165.2 kJ•mol-1;a;
(3)利用反应②,将CO进一步转化,可提高H2产量,若1mol CO和H2的混合气体(CO的体积分数为20%)中 CO为0.2mol,H2的物质的量为0.8mol,与H2O反应,得到1.18mol CO、CO2和H2的混合气体,依据反应前后气体体积不变,增加的部分应该是起始的水蒸气的物质的量为0.18mol,设转化的一氧化碳的物质的量为x,依据化学平衡三段式列式计算
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2 kJ•mol-1
起始量(mol) 0.2 0.18+x 0 0.8
变化量(mol) x x x x
平衡量(mol)0.2-x 0.18 x x+0.8
则0.2-x+x+x+0.8=1.18,x=0.18
则CO转化率为$\frac{0.18mol}{0.2mol}$×100%=90%
故答案为:90%;
(4)依据反应特征N2+3H2=2NH3 △V
1 3 2 2
平衡体积 V V
即反应前后气体体积减小为生成氨气的体积,相同条件下,气体体积比等于气体物质的量之比,图象分析可知平衡状态氨气体积含量42%,设平衡混合气体体积为100,氨气为体积42,则反应前气体体积100+42=142,氮气和氢气按照1:3混合,氮气体积=142×$\frac{1}{4}$=35.5,依据化学方程式计算反应的氮气体积为21,平衡状态氮气为35.5-21=14.5,则氮气体积分数为14.5%;
故答案为:14.5%;
(5)合成氨的反应是放热反应,开始反应,氨气物质的量增大,达到平衡状态,继续升温,平衡逆向进行,氨气物质的量减小,画出的图象为: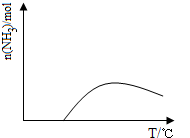 ;
;
故答案为: ;
;
(6)提高合成氨原料总转化率,依据平衡移动原理分析,分离出氨气促进平衡正向进行,把平衡混合气体中氮气和氢气重新循环使用,提高原理利用率;
故答案为:对原料气加压或分离液氨后未反应的N2、H2循环使用.
点评 本题考查了化学平衡影响因素分析,平衡计算应用,注意反应特征的计算应用,图象绘制,掌握基础是关键,题目难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 分散质粒子直径都在1~100nm之间 | B. | 均能产生丁达尔效应 | ||
| C. | 用漏斗过滤时滤纸上没有滤渣留下 | D. | 均呈红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 待提纯的物质 | 选用的试剂 | 操作的方法 |
| A | CaO(CaCO3) | 水 | 溶解、过滤、结晶 |
| B | Cu(CuO) | 稀盐酸 | 溶解、过滤、洗涤、干燥 |
| C | CuSO4(H2SO4) | 氢氧化钠溶液 | 过滤 |
| D | ZnSO4(CuSO4) | Zn(OH)2 | 溶解、过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中:Cl-,Na+,Fe3+,SO42- | |
| B. | 水电离的H+浓度c(H+)=10-12mol/L的溶液中:Cl-,CO32-,NH4+,S2O32- | |
| C. | 使pH=1溶液中:K+、Fe2+、NO3-、Cl- | |
| D. | 含有HCO3-的溶液中:NH4+、K+、Na+、SO32-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用丁达尔效应区分溶液和胶体 | |
| B. | 胶体能透过半透膜,但不能透过滤纸 | |
| C. | Fe(OH)3胶体的电泳实验说明了胶体粒子带有电荷 | |
| D. | 江河入海口三角洲的形成,通常与胶体的性质有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入硝酸银溶液,生成白色沉淀,加稀盐酸沉淀不消失,一定有Cl- | |
| C. | 加入NaOH溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 滴加BaCl2溶液,生成白色沉淀,再加入稀硝酸沉淀不溶,一定有SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com