
| A. | 电子由Zn电极流出,经KOH溶液流向正极 | |
| B. | 正极反应式为2FeO42-+10H++6e-=Fe2O3+5H2O | |
| C. | 该电池放电过程中电解质溶液浓度不变 | |
| D. | 电池工作时OH-向负极迁移 |
分析 某电池以K2FeO4和Zn为电极材料,KOH溶液为电解溶质溶液,原电池发生工作时,Zn被氧化,为原电池的负极,K2FeO4具有氧化性,为正极,碱性条件下被还原生成Fe(OH)3,结合电极方程式以及离子的定向移动解答该题.
解答 解:A.根据化合价升降判断,Zn化合价只能上升,故为负极材料,电子从负极流出经导线流向正极,电子不能流入电解质溶液,故A错误;
B.KOH溶液为电解质溶液,则正极电极方程式为2FeO42-+6e-+8H2O=2Fe(OH)3+10OH-,故B错误;
C.根据总反应3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH可知该电池放电过程中电解质溶液浓度增大,故C错误;
D.电池工作时阴离子OH-向负极迁移,故D正确.
故选D.
点评 本题考查原电池知识,侧重考查学生的分析能力,题目较为基础,注意从元素化合价的角度分析,把握原电池与氧化还原反应的关系,难度不大.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+、K+、Cl-、S2-四种离子的半径依次减小 | |
| B. | 熔融的NaHSO4中阴阳离子的数目比为1:2 | |
| C. | 氢化锂三兄弟--LiH、LiD、LiT三种物质的质子数之比为4:5:6 | |
| D. | 一个乙醛分子中存在7对共用电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
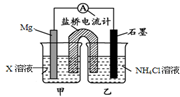
| A. | 盐桥中的K+移向乙烧杯 | |
| B. | 乙烧杯中一直存在:c(Cl-)>c(NH4+) | |
| C. | X可能是CuCl2 | |
| D. | 石墨电极反应式为2NH4++2e-═2NH3↑+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO的结构式:H-O-Cl | B. | X=11,图表示钠原子的结构示意图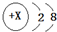 | ||
| C. | CCl4的电子式: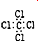 | D. | 乙炔的最简式:C2H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作、现象 | 结 论 | |
| A | 火柴梗上滴少量的浓硫酸;火柴梗变黑 | 浓硫酸具有强氧化性 |
| B | 含锈的铁浸泡在NH4Cl溶液中,铁锈逐渐溶解 | NH4Cl显酸性 |
| C | Ba(NO3)2溶液中通入SO2气体;产生白色沉淀 | BaSO3难溶 |
| D | 某无色溶液中通入过量的CO2气体,有白色沉淀 | 一定含有AlO2- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高纯硅是工业上制造光导纤维的主要原料 | |
| B. | 开发和推广新能源汽车是实现低碳生活的途径之一 | |
| C. | 寻找高效催化剂,利用太阳能分解水是制取氢气的较理想方法 | |
| D. | 不需要通过化学反应就能从海水中获得淡水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 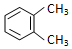 与 与 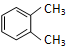 是同一种物质,说明苯分子中碳碳双键、碳碳单键交替排列 是同一种物质,说明苯分子中碳碳双键、碳碳单键交替排列 | |
| B. | 苯在空气中不易燃烧完全,燃烧时冒浓烟,说明苯组成中含碳量较高 | |
| C. | 煤干馏得到的煤焦油可以分离出苯,苯是无色无味的液态烃 | |
| D. | 向2mL苯中加入1mL溴的四氯化碳溶液,振荡后静置,可观察到液体分层,上层呈橙红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com