

| 第一次实验 | 第二次实验 | 第三次实验 | |
| D中固体用量 | 2.0g | 2.0g | 2.0g |
| 氢气的体积 | 334.5mL | 336.0mL | 337.5mL |
| 步骤 | 实验操作 | 预测现象和结论 |
| ① | 往不再产生氯气的装置中,加入NaCl固体,继续加热 | 若有黄绿色气体生成,则假设1成立 |
| ② | 往不再产生氯气的装置中,加入浓硫酸并继续加热 | 若有黄绿色气体生成,则假设2成立 |
分析 本题分三块,制备氯化铝、氯化铝的纯度分析、探究实验室制氯气的反应原理,其中氯化铝制备是利用二氧化锰和浓盐酸混合加热制得氯气与铝粉共热制备氯化铝,实验过程中要关注氯气的净化、保持无氧环境(防止生成氧化铝)、干燥环境(防氯化铝水解),并进行尾气处理减少对环境的污染;氯化铝样品中可能混有铝,利用铝与氢氧化钠溶液反应生成的氢气测定铝的含量,再计算出氯化铝的纯度;探究实验室制备氯气的原理可从来二个方面分析(1)氯离子浓度对实验的影响(2)H+对实验的影响;
(1)实验室是利用二氧化锰与浓盐酸混合加热制氯气的,可据此写出反应化学方程式;
(2)实验前装置里充满空气,空气时有氧气,必须先利用生成的氯气除去,否则制得的氯化铝中会混有氧化铝,根据此思路确定操作顺序;
(3)实验操作过程中制氯气需要浓盐酸和二氧化锰,除氯气中混合的氯化氢需要饱和食盐水,干燥氯气需要浓硫酸,铝粉参加氯气的氧化制氯化铝,用氯化钙作干燥剂防水汽进入硬质管内,用氢氧化钠溶液吸收含有氯气的尾气,由此可看出不需要的化学药品;
(4)无水AlCl3与水蒸气发生的是水解反应;
(5)根据三次实验生成的氢气求平均值,再根据生成的氢气求出参加反应的铝,即可计算出氯化铝的质量分数;
(6)氯化铝的含量偏低,除部分不参加反应的铝外,还可能有部分铝被氧气氧化;
(7)二氧化锰与浓盐酸反应的离子方程式为MnO2+2Cl-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,可见影响反应进行离子应该是氯离子或氢离子的浓度;
(8)选择试剂时要注意,考虑氯离子时不要影响H+的浓度,同理考虑氢离子时不能影响氯离子浓度,故探究氯离子浓度的影响,只要通过氯化钠补充氯离子就可以了,探究H+浓度的影响只要探究添加浓硫酸补充H+就可以了.
解答 解:(1)实验室用二氧化锰与浓盐酸反应制氯气的反应方程式为MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)实验开始前,先检查装置气密性,然后装入药品,接下来先添加浓盐酸再加热A中酒精灯,待硬质玻璃管中充满黄绿色气体后再加热D装置,正确操作顺序为bca,故答案为:bca;
(3)实验过程中要关注氯气的净化、保持无氧环境(防止生成氧化铝)、干燥环境(防氯化铝水解),并进行尾气处理减少对环境的污染,可知不需要的药品是稀盐酸、稀硫酸即③⑦,故答案为:③⑦;
(4)无水氯化铝遇水蒸汽,Al3+的水解在受热条件下反应快速进行,反应方程式为AlCl3+3H2O(g)=Al(OH)3+3HCl,故答案为:AlCl3+3H2O(g)=Al(OH)3+3HCl;
(5)三次实验收集到的氢气平均值为(334.5mL+336.0mL+337.5mL)÷3=336.0mL,氢气的物质的量为$\frac{336×1{0}^{-3}L}{22.4L/mol}$=0.015mol,根据2Al~3H2,可知铝的物质的量为$\frac{0.015mol×2}{3}$=0.01mol,质量为0.01mol×27g/mol=0.27g,氯化铝的质量分数为$\frac{2.0g-0.27g}{2.0g}×100%$=86.5%,故答案:86.5%;
(6)氯气量不足,部分铝未反应生成氯化铝,可导致氯化铝含量偏低;固体和气体无法充分接触,部分铝粉未被氯气氧化,混有铝,导致氯化铝含量偏低;有少量氯化铝升华,也能导致氯化铝含量偏低;故答案为:①②③;(7)根据实验室利用浓盐酸和二氧化锰混合加热反应原理可知,参加离子反应的离子为氯离子和氢离子,另一种假设为H+浓度影响氯气的生成,故答案为:H+浓度影响氯气的生成;
(8)可通过向反应装置中添加NaCl固体的方法增加溶液里的氯离子浓度,添加浓硫酸的方法增加溶液里的H+浓度,故答案为:氯化钠固体;往不再产生氯气的装置中,加入浓硫酸并继续加热.
点评 本题综合程度较高,考查了氯气与氯化铝的制备,探究了氯化铝含量测定及氯气制备原理,涉及物质的量计算、实验操作的选择等,知识面广,但难度中等,对学生基础要求较高,对学生的解题能力提高有一定帮助.


科目:高中化学 来源: 题型:选择题
| A. | 该溶液中一定含硫酸根离子 | |
| B. | 该溶液中一定含有银离子 | |
| C. | 该溶液中一定含有硫酸根离子和银离子 | |
| D. | 该溶液中可能含有硫酸根离子或银离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 甲同学 | 乙同学 | |
| 选用试剂 | A1C13溶液、NaOH溶液 | A12(SO4)3溶液、氨水 |
| 操作 | 向AlCl3溶液中逐滴加入NaOH溶液至过量 | 向A12(SO4)3溶液中逐滴加入氨水至过量 |
| 实验现象 | 先产生白色沉淀,然后沉淀逐渐消失 | |
| 化学方程式 | AlCl3+3NaOH=Al(OH)3↓+3NaClAl(OH)3+NaOH=NaAlO2+2H2O | A12(SO4)3+6NH3•H2O═2A1(OH)3↓+3(NH4)2SO4 |
| 离子方程式 | Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=AlO2-+2H2O | Al3++3NH3•H2O=Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
一定条件下,通过下列反应可实现燃煤烟气中硫的回收:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
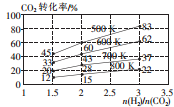 二氧化碳是造成温室效应的主要气体,二氧化碳的回收再利用是减缓温室效应的有效途径之一.
二氧化碳是造成温室效应的主要气体,二氧化碳的回收再利用是减缓温室效应的有效途径之一.| 温度/K CO2转化率/% a/mol | 500 | 600 | 700 | 800 |
| 1.67 | x | 33 | ||
| 1.25 | 60 | 43 | y | |
| 0.83 | z | 32 | w |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 阿司匹林的相对分子质量为180,是一种常用的药品.
阿司匹林的相对分子质量为180,是一种常用的药品. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别加水稀释10倍,两溶液的pH仍相等 | |
| B. | 温度升高10℃,两溶液的pH均不变 | |
| C. | 加入适量的氯化铵晶体后,两溶液的pH均减小 | |
| D. | 用相同浓度的盐酸中和至反应完全时,消耗盐酸的体积相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由H原子形成1 mol H-H键要吸收热量 | |
| B. | 所有燃烧反应都是放热反应 | |
| C. | 在稀溶液中,1 mol酸与1 mol碱发生中和反应生成水时所释放的热量称为中和热 | |
| D. | 在一定条件下,1mol H2 与足量的Cl2、Br2、I2 分别反应,放出热量关系是I2>Br2>Cl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com