
| A. | CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1(燃烧热) | |
| B. | OH-(aq)+H+(aq)=H2O(l)△H=+57.3 kJ•mol-1(中和热) | |
| C. | 2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ•mol-1(反应热) | |
| D. | 2NO2=O2+2NO△H=+116.2 kJ•mol-1(反应热) |
分析 A.燃烧热的热化学方程式中生成稳定氧化物;
B.中和反应为放热反应;
C.燃烧为放热反应,物质的量与热量成正比,物质能量与状态有关;
D.热化学方程式中应注明物质的状态.
解答 解:A.燃烧热方程式应为CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3 kJ•mol-1,液态水稳定,故A错误;
B.中和热方程式为OH-(aq)+H+(aq)=H2O(l)△H=-57.3 kJ•mol-1,故B错误;
C.2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ•mol-1为反应热的热化学方程式,故C正确;
D.表示反应热的热化学方程式为2NO2(g)=O2(g)+2NO(g)△H=+116.2 kJ•mol-1,故D错误;
故选C.
点评 本题考查热化学方程式的书写,为高频考点,把握热化学方程式的书写方法、燃烧热及中和热判断为解答本题的关键,侧重分析与应用能力的考查,注意焓变及物质状态,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
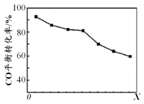 密闭容器中,由H2和CO直接制备二甲醚(CH3OCH3),其过程包含以下反应:
密闭容器中,由H2和CO直接制备二甲醚(CH3OCH3),其过程包含以下反应:| A. | 由H2和CO直接制备二甲醚的反应为放热反应 | |
| B. | 条件X为压强 | |
| C. | X增大,二甲醚的产率一定增大 | |
| D. | X增大,该反应的平衡常数一定减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 31.8g | B. | 53g | C. | 63.6g | D. | 84g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2与O3互为同素异形体 | |
| B. | 35Cl与37Cl互为同位素,两者核外电子排布不同 | |
| C. | CH4与C3H8一定互为同系物 | |
| D. | CH3CH2NO2与H2NCH2COOH互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
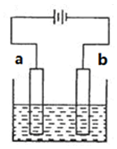
| A. | 精炼铜时,a极为粗铜,b极为精铜 | |
| B. | 电镀铜时,a极为镀件,b极为铜 | |
| C. | 保护铁时,a极为铁片,b极为锌片 | |
| D. | 惰性电极电解饱和食盐水时,b极有黄绿色气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 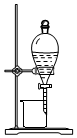 如图所示装置可从碘的CCl4溶液中分离出碘 | |
| B. | 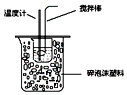 如图所示装置可用于在实验室测定中和反应的反应热 | |
| C. | 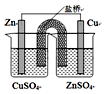 如图所示装置能构成锌铜原电池 | |
| D. | 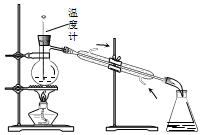 如图所示装置可用于实验室中分馏石油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.7克氨气中含有0.1NA个NH3分子 | |
| B. | 标准状况下,2.24 L Cl2溶于水所得溶液中含有Cl_0.1NA | |
| C. | 标准状况下,2.24 L H2O中含有0.1 NA个氧原子 | |
| D. | 0.1mol铁在足量氯气中燃烧,电子转移0.2NA个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com