
【题目】298K时,二元弱酸H2X溶液中含X微粒的分布分数如图所示。下列叙述正确的是
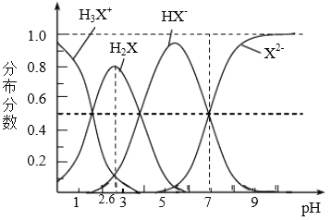
A. 溶液pH由l升至2.6时主要存在的反应是:H3X++OH-=H2X+H20
B. H2X的第二步电离平衡常数Ka2(H2X)为10-4
C. NaHX溶液中c(H+)<c(OH-)
D. 当溶液呈中性时:c(Na+)=2c(X2-)
【答案】A
【解析】
A、溶液pH由1至2.6时,从图中可以判断主要是将H3X+转化为H2X,即反应为H3X++OH-=H2X+H20,A正确;
B、溶液显中性,pH=7的时候,溶液中的HX-和X2-相等,所以![]() ,B错误;
,B错误;
C、从图中可以判断当HA-占主导的时候,溶液显酸性,所以NaHX溶液显酸性,即c(H+)>c(OH-),C错误;
D、溶液显中性,pH=7的时候,溶液中的HX-和X2-相等,存在的电荷守恒为c(Na+)+c(H+)=2c(X2-)+c(HX-)+c(OH-),因为溶液显中性有c(H+)=c(OH-),所以得到c(Na+)=2c(X2-)+c(HX-),D错误。
答案选A。


科目:高中化学 来源: 题型:
【题目】某同学在实验中不小心将几滴新制氯水滴入盛有溴化亚铁溶液的试剂瓶中,发现溶液变成了黄色,根据已有化学知识,请你参与上述现象形成原因的分析与探究:
(1)提出问题猜想:
猜想一:溶液呈黄色是因发生离子反应①_________________________________________(填离子方程式)所致。
猜想二:溶液呈黄色是因发生离子反应②______________________________________(填离子方程式)所致。
(2)设计实验并验证
为验证①与②中是哪个原因导致了溶液变黄色,设计并进行了以下实验。请根据以下所给试剂,进行合理选用,完成实验方案1和方案2:__________________、______________、__________________、______________。

(3)实验结论:以上实验不仅验证了溶液变黄的真实原因,同时证明了Fe2+的还原性比Br-______________(填“强”或“弱”)。
(4)实验反思
Ⅰ.根据上述实验推测,若在溴化亚铁溶液中滴入足量氯水,再加入CCl4并充分振荡后静止,产生的现象是______________________________________。
Ⅱ.在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有1/2的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把Ca(OH)2固体放入一定量的蒸馏水中,一定温度下达到平衡:Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq).当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是 ( )
Ca2+(aq)+2OH-(aq).当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是 ( )
A. 溶液中Ca2+数目增多 B. 溶液中c(Ca2+)增大
C. 溶液pH值不变 D. 溶液pH值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用Ga与NH3高温条件下合成固体半导体材料氮化稼(GaN)同时有氢气生成。反应中,每生成3molH2时放出30.8kJ的热量。恒温恒容密闭体系内进行上述反应, 下列有关表达正确的是
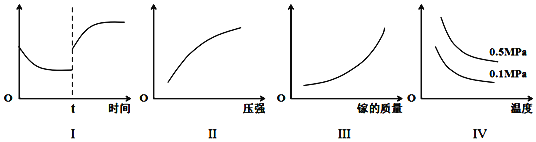
A. I图像中如果纵坐标为正反应速率,则t时刻改变的条件可以为升温或加压
B. II图像中纵坐标可以为镓的转化率
C. III图像中纵坐标可以为化学反应速率
D. IV图像中纵坐标可以为体系内混合气体平均相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生以下反应:
2N2O5(g)![]() 4NO2(g)+ O2(g) ΔH>0
4NO2(g)+ O2(g) ΔH>0
T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
时间/s | 0 | 500 | 100 0 | 150 0 |
c(N2O5)/mol·L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法中不正确的是
A.500 s内N2O5分解速率为2.96╳10-3mol·L-1·s-1
B.T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为50%
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
D.达平衡后其他条件不变,将容器的体积压缩到原来的1/2,则c(N2O5)> 5.00 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图的各方框表示有关的一种反应物或生成物(某些物质已经略去),其中常温下A、C、D、E为无色气体,C能使湿润的红色石蕊试纸变蓝,B常温下为无色液体,Fe遇浓的G溶液钝化。

(1)写出下列各物质的化学式:
B:____________;F:____________;G:___________。
(2)写出下列变化的反应方程式:
A→D:________________________________________;
G→E:________________________________________。
(3)实验室里,常用加热_____________________的混合物的方法制取气体C,常采用____________法来收集。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O)俗称吊白块,不稳定,120℃时会分解。在印染、医药以及原子能工业中有广泛应用。以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:

步骤1:在三颈烧瓶中加入一定量Na2S03和水,搅拌溶解,缓慢通入SO2,至溶液pH约为4,制得NaHS03溶液。
步骤2:将装置A中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90℃下,反应约3h,冷却至室温,抽滤;
步骤3:将滤液真空蒸发浓缩,冷却结晶。
(1)装置B的烧杯中应加入的溶液是____:冷凝管中冷却水从____(填“a”,或“b”)口进水。
(2)A中多孔球泡的作用是________。
(3)冷凝管中回流的主要物质除H20外还有____(填化学式)。
(4)步骤3中在真空容器中蒸发浓缩的原因是____。
(5)为测定产品的纯度,准确称取2.Og样品,完全溶于水配成l00mL溶液,取20.00mL所配溶液,加过量碘完全反应后(己知I2不能氧化甲醛,杂质不反应),加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.466g,产品的纯度为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】12 mL 0.1 mol·L-1的Na2SO3溶液恰好与20 mL 0.02 mol·L-1的K2Cr2O7(重铬酸钾)溶液完全反应。已知Na2SO3被K2Cr2O7氧化为Na2SO4,则Cr在还原产物中的化合价为( )
A. +2 B. +3 C. +4 D. +5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com